


研究目的:利用全基因组甲基化WGBS探索疾病外周血DNA甲基化表观特征
样本信息:Coffin–Siris和Nicolaides–Baraitser综合征(CSS and NCBRS)患者外周血样本
结论:本文报告了CSS(ARID1B、SMARCB1和SMARCA4)和NCBRS(SMARCA2)各种亚型个体的外周血DNA甲基化表征的重叠情况,发现某些CSS亚型和NCBRS的外显特征的相似程度可能大于CSS内部的相似程度,表明这两种综合征在功能基础上有联系。染色体6q25微缺失综合征,携带ARID1B缺失,表现出类似CSS/NCBRS的甲基化特征。这一表征的特异性在广泛的神经发育疾病中得到证实,包括其他染色质重塑和表观遗传机制疾病。根据这种DNA甲基化图谱训练的机器学习模型可以解决模棱两可的临床病例,重新分类那些意义不明的变体,并通过有针对性的人群筛查识别以前未诊断的对象。

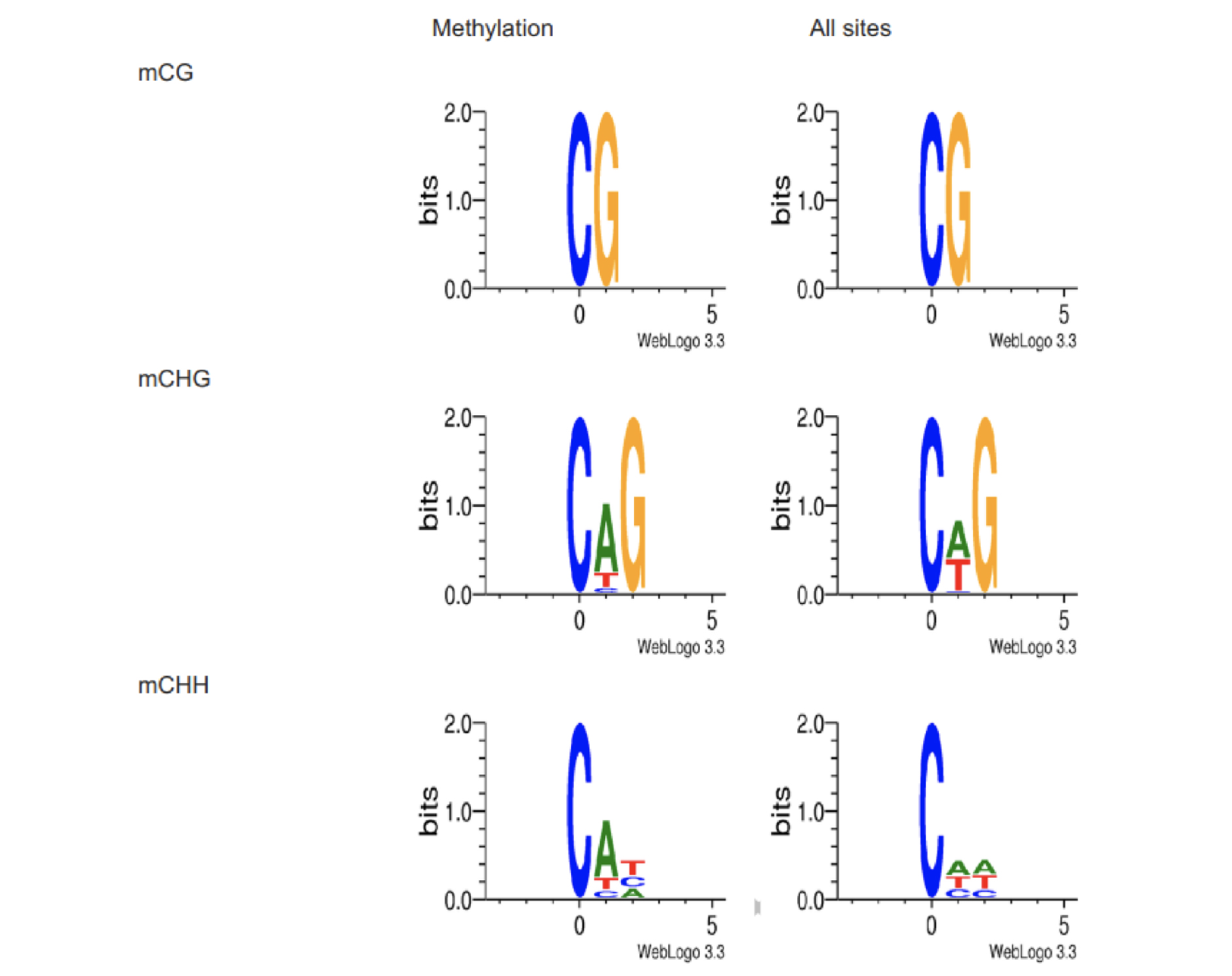
甲基化位点motif识别 Motif表示包含mC位点在内的上下游9bp的碱基分布特征,可以表征序列保守性,其可能在基因表达调控中发挥作用。motif分析对DNA-protein binding sites等的发现有重要的意义。对于各个序列环境(CG,CHG,CHH),我们使用全基因组该序列环境位点信息和鉴定为甲基化的位点序列信息(取包括位点在内的9bp的碱基)作Logo Plots ( Lister R , Pelizzola M , Dowen RH et al. (2009) ),研究不同context下甲基化胞嘧啶上下游的序列特征,结果如下图所示:
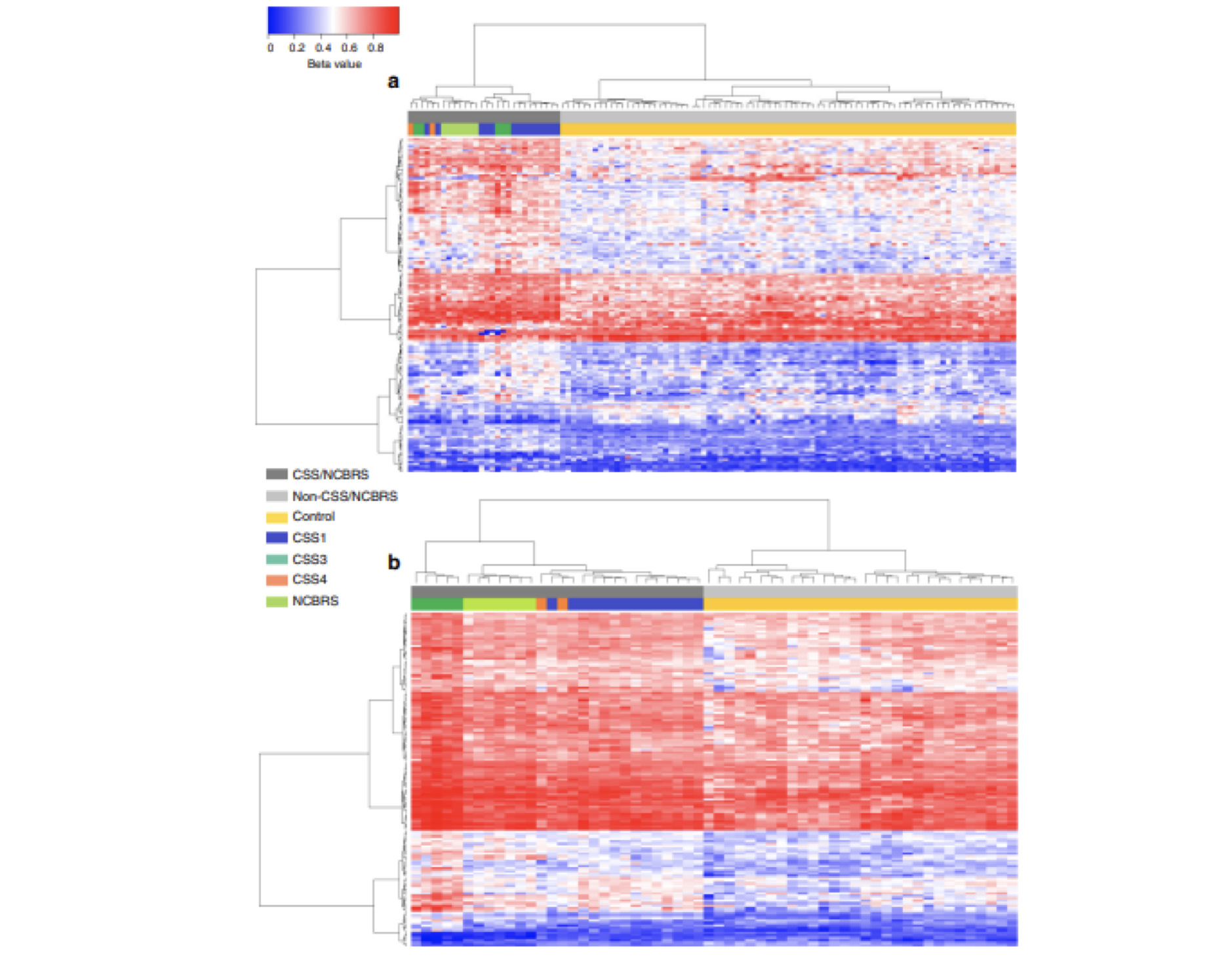
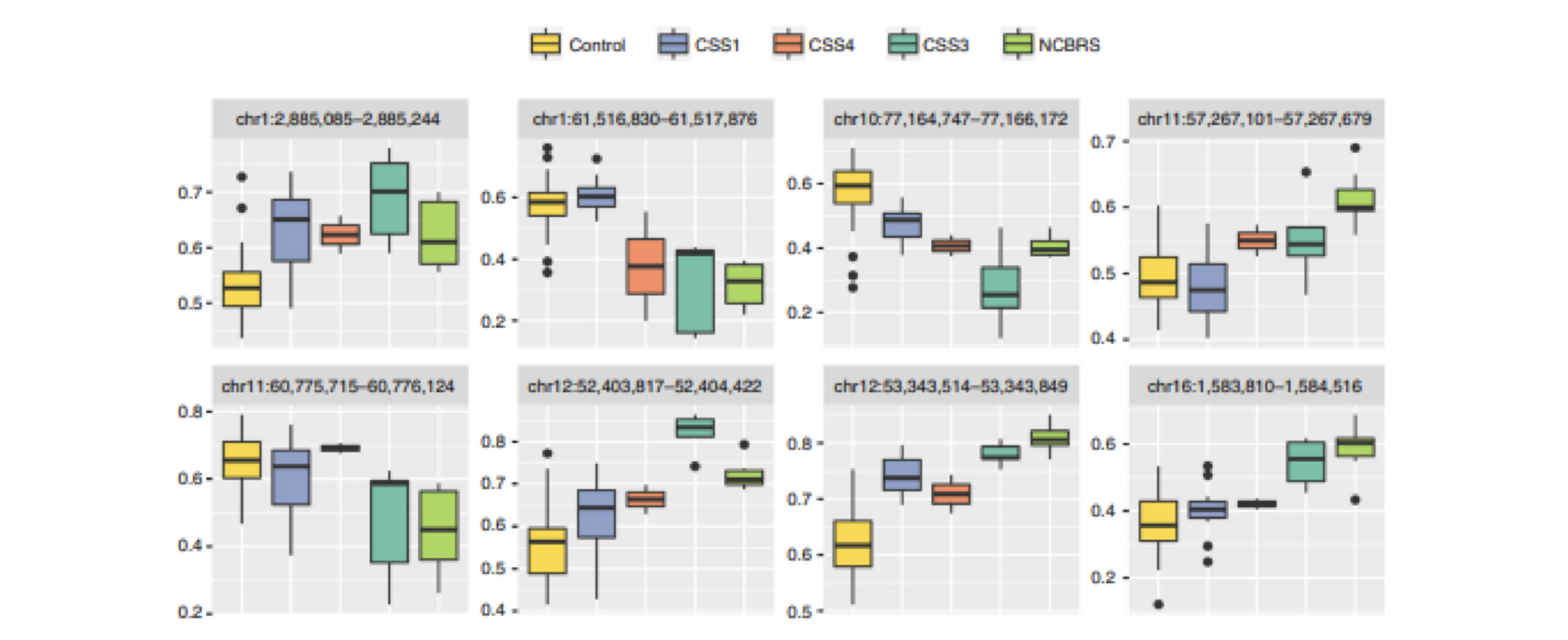
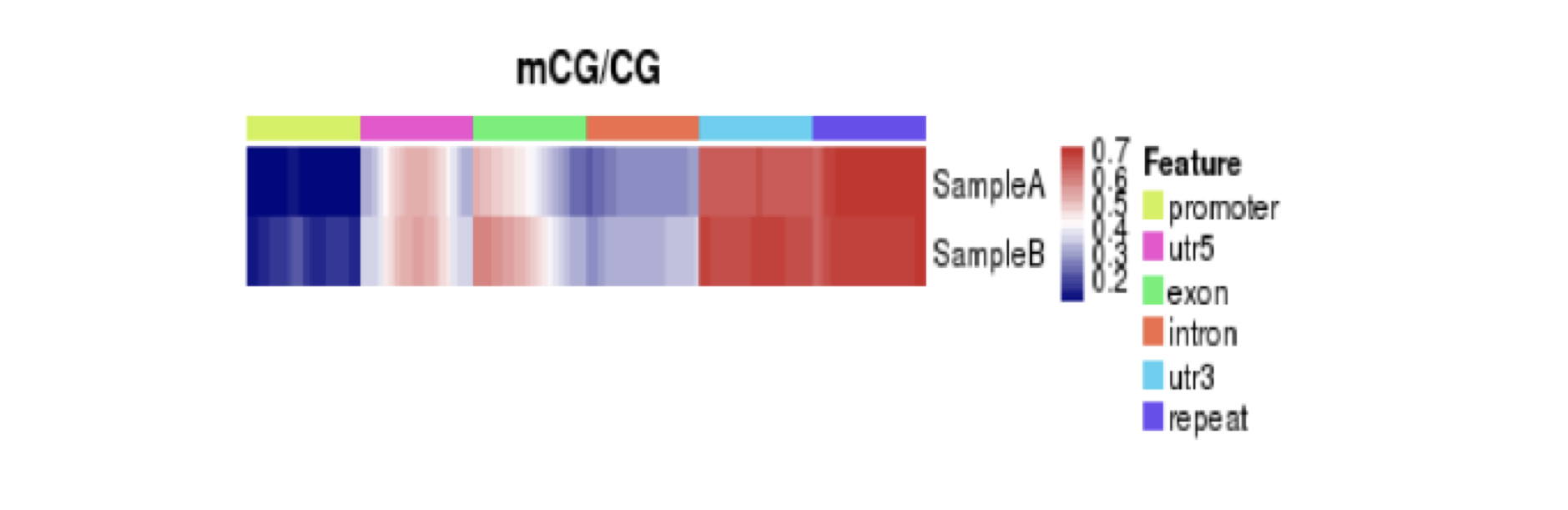
对于样本间功能区域甲基化水平进行热图分析,能反映各个样本在基因功能区域甲基化水平分布的一致程度:
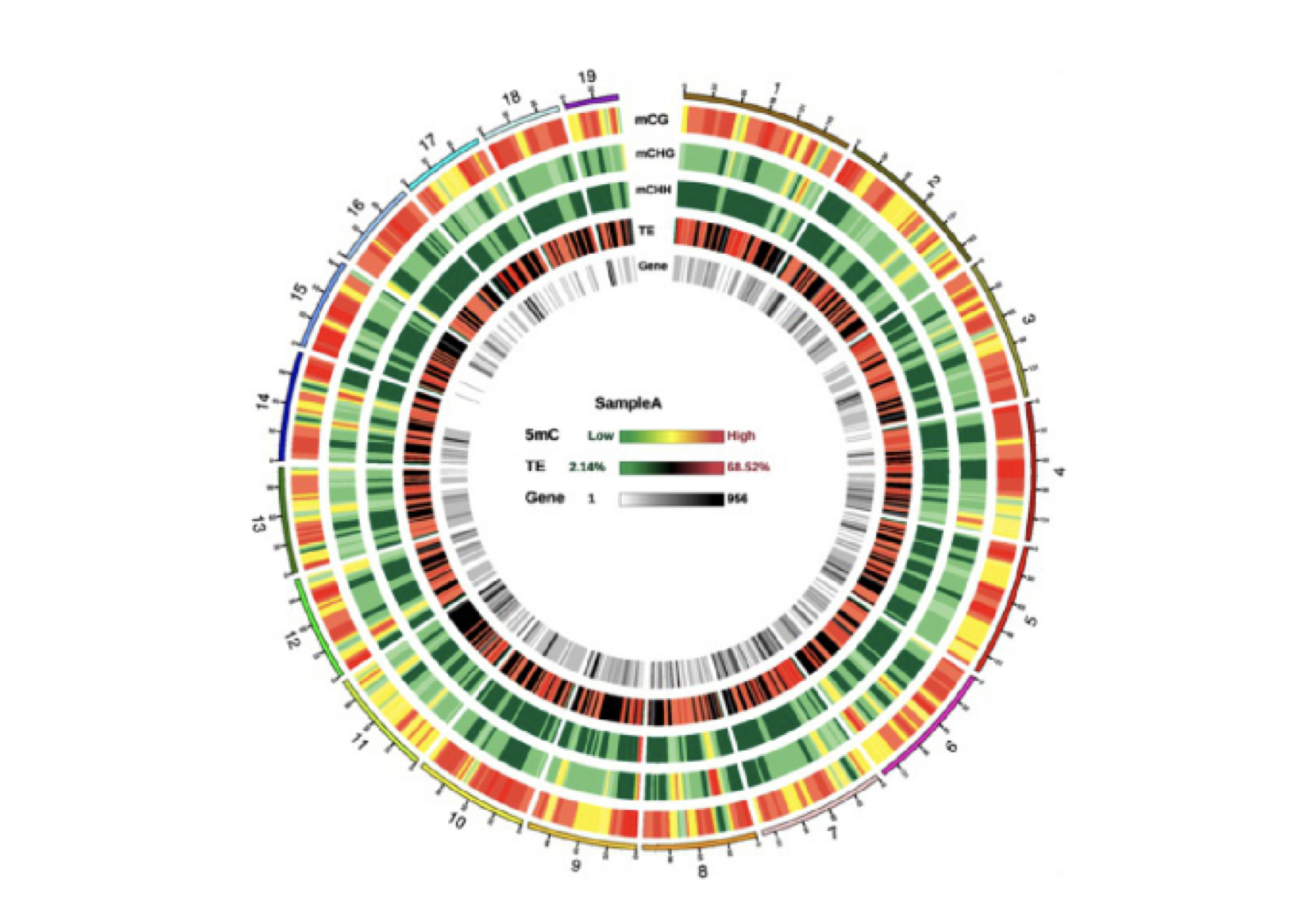
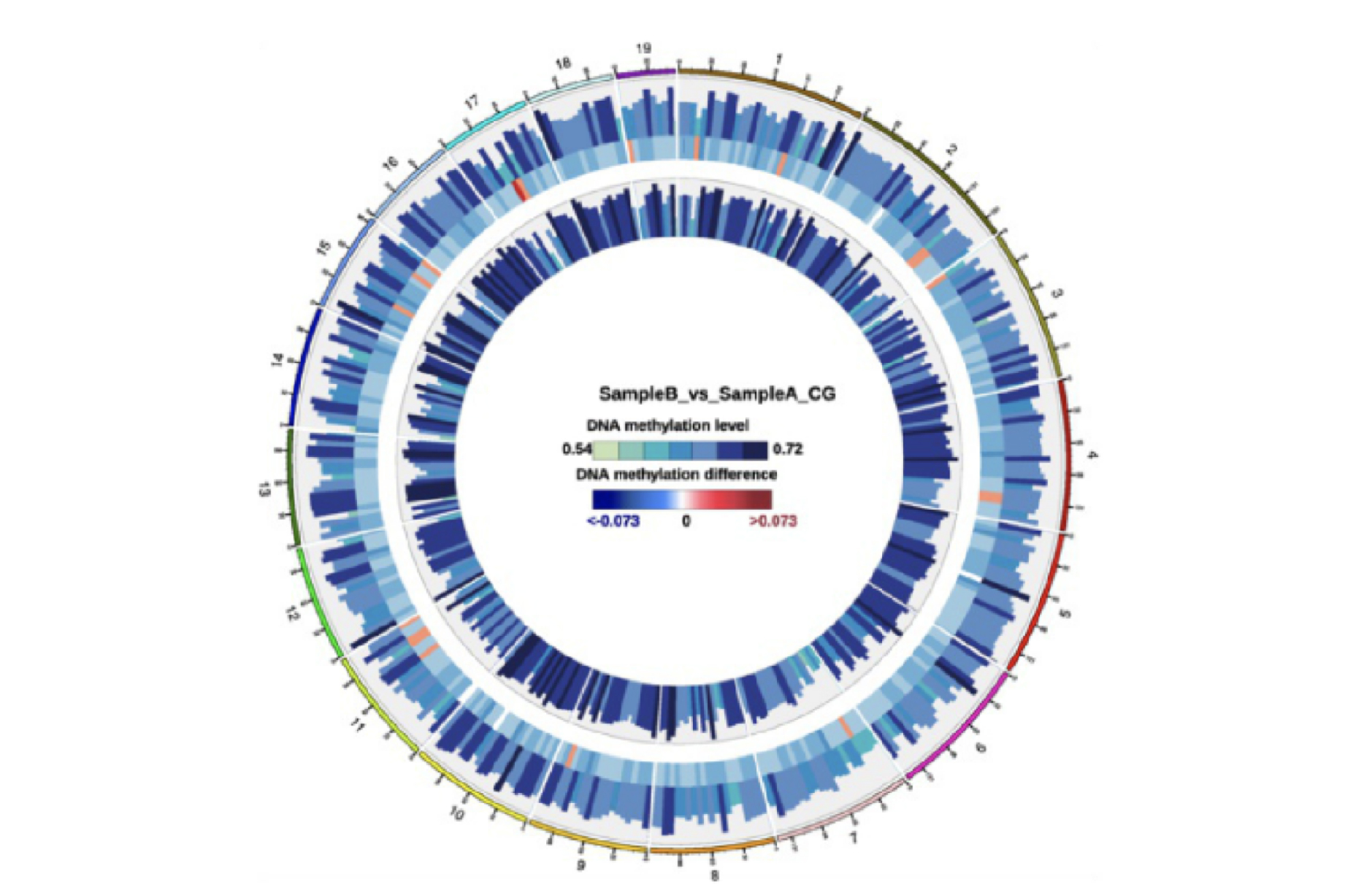
 甲基化水平差异circos图
甲基化水平差异circos图
采用circos图在全基因组范围内展示不同比较组样本的甲基化水平及整体差异情况 :
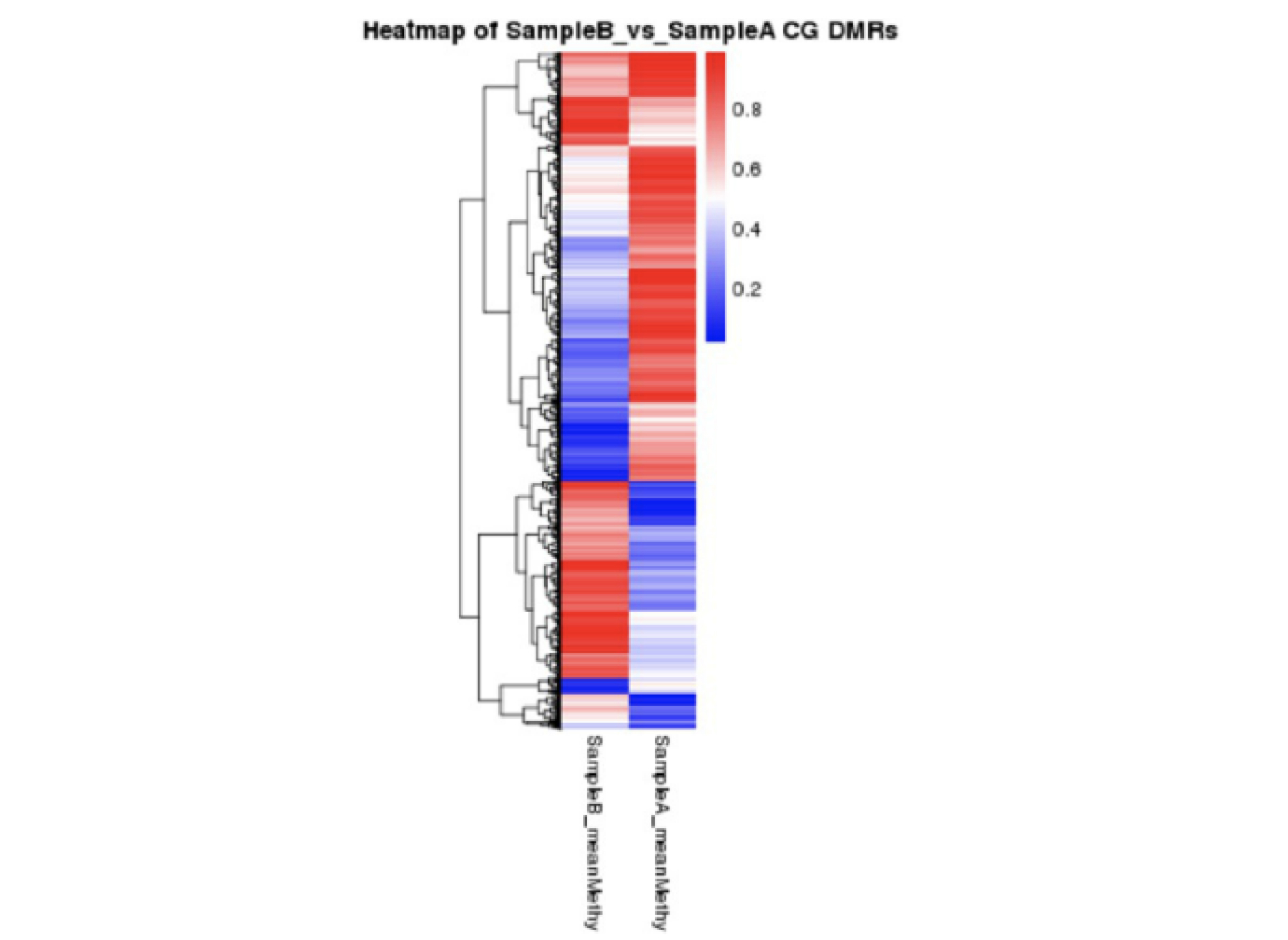
DMR 甲基化水平聚类热图
对于 DMR 甲基化水平,DSS 软件给出差异甲基化区域的平均甲基化水平,用以绘制聚类热图,以展示组合间甲基化情况和差异情况 。结果如下:
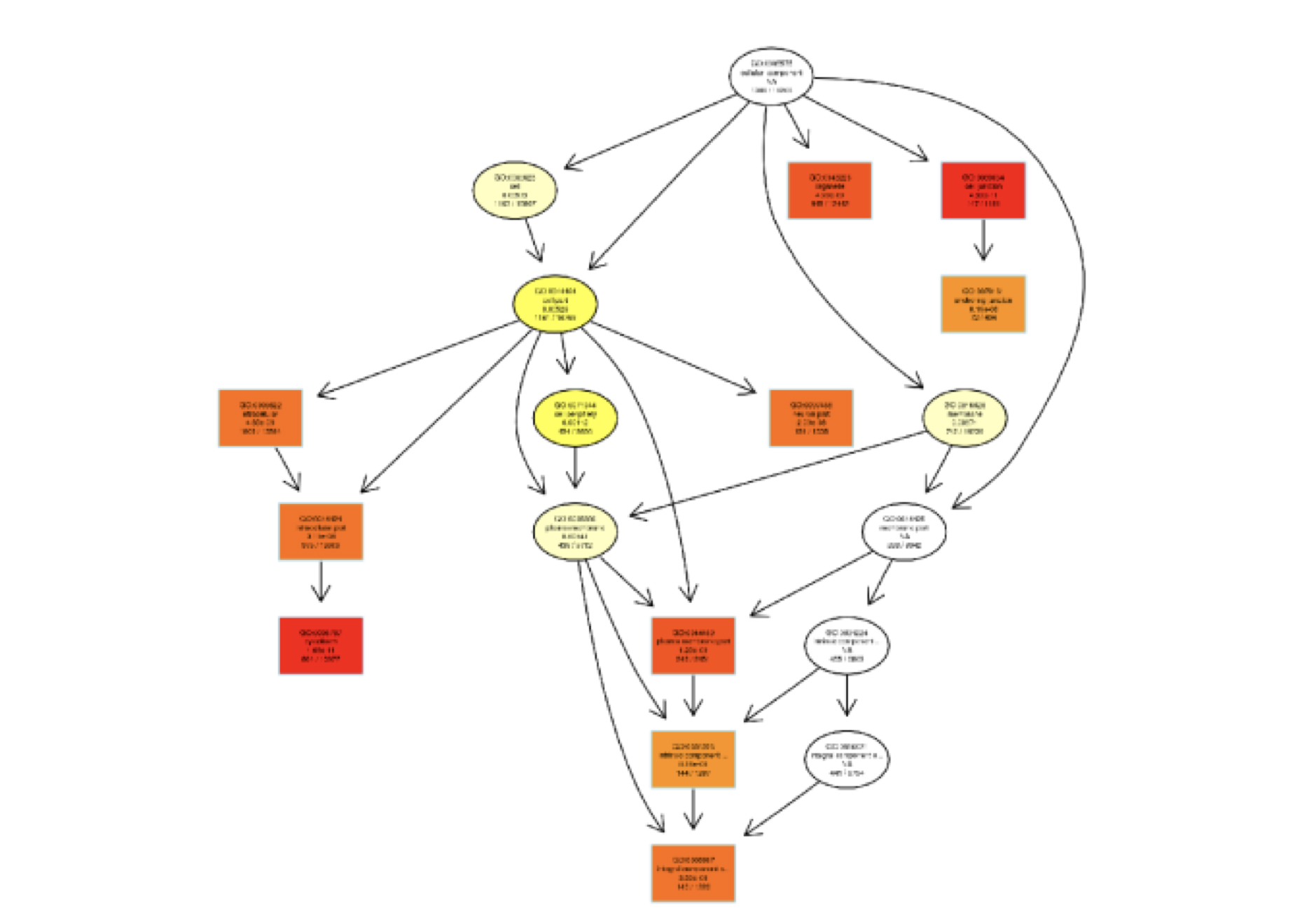
DMR相关基因GO富集分析
有向无环图(Directed Acyclic Graph,DAG)为DMR相关基因( 分序列环境 )GO富集分析结果的图形化展示方式,分支代表包含关系,从上至下所定义的 功能范围越来越小,一般选取GO富集分析的结果前10位作为有向无环图的主节点,并通过包含关系,将相关联的GO Term一起展示,颜色的深浅代表富集程 度。我们的项目中分别绘制生物过程(biological process)、分子功能(molecular function)和细胞组分(cellular component)的DAG图。
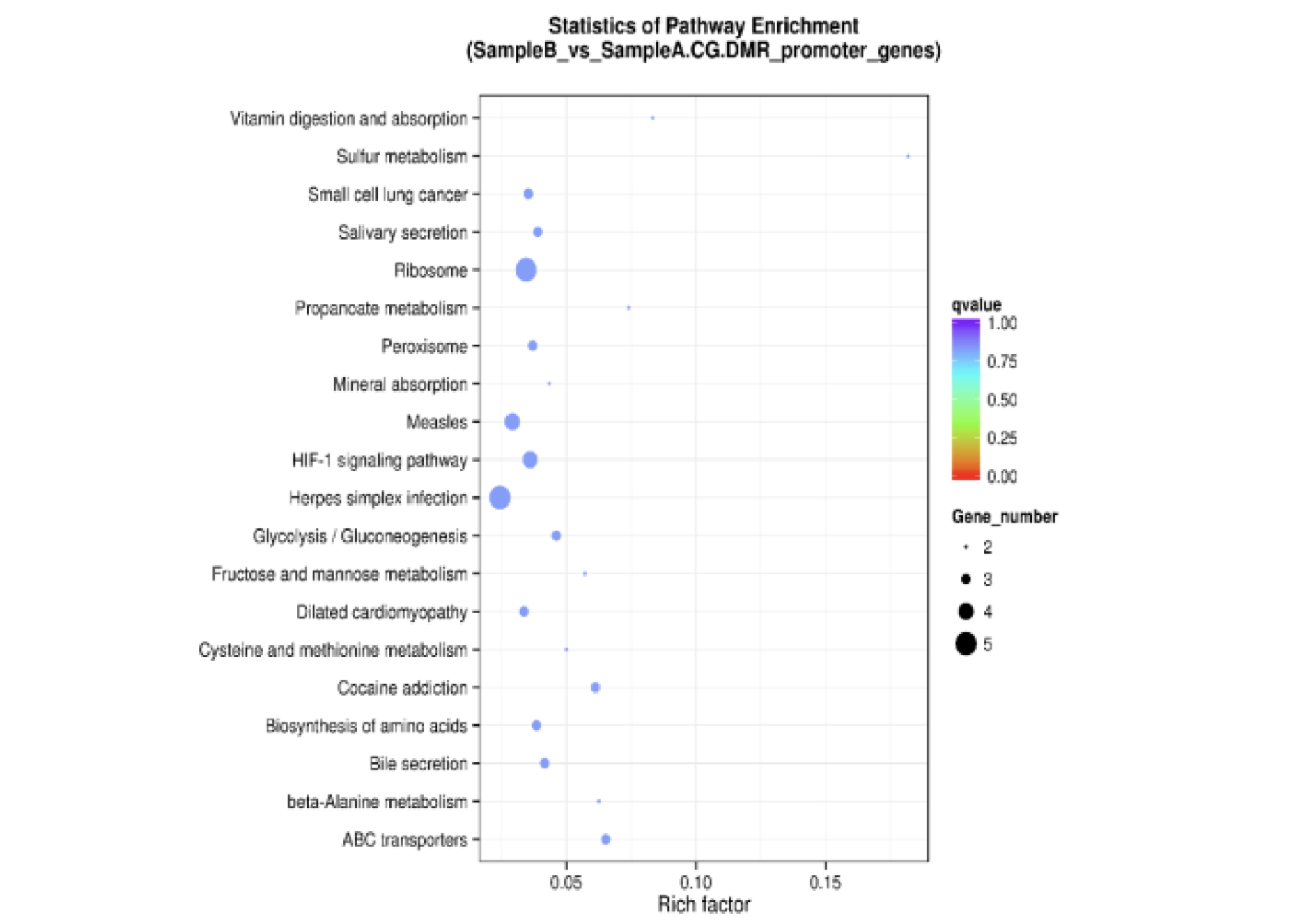
DMR相关基因KEGG富集分析
散点图是KEGG富集分析结果的图形化展示方式。在此图中,KEGG富集程度通过Rich factor、Qvalue和富集到此通路上的基因个数来衡量。其中Rich factor指该pathway中富集到的DMR相关基因个数与注释基因个数的比值。Rich factor越大,表示富集的程度越大。Qvalue是做过多重假设检验校正之后的Pvalue,Qvalue的取值范围为[0,1],越接近于零,表示富集越显著。我们挑选了富集最显著的20条pathway条目在该图中进行展示,若富集的pathway条目不足20条,则全部展示。
|
|
全基因组甲基化测序(WGBS) |
|
gDNA |
基因组DNA用TE溶解,总量≥10μg,纯度OD260/280在1.8-2.0之间,浓度≥50ng/μl(Qubit检测浓度,不是NanoDrop的浓度检测) |
|
细胞样本 |
|
|
组织样本 |
|
|
血液样本 |
|
|
外周血cell-free |
1、使用Streck cell-free血浆游离DNA采血管进行采血,采血总量≥10ml,具体使用方法见Streck 说明书 |
细胞样本在甲基化研究,尤其是临床方向的研究中,是最为主要的样本来源。对于细胞样本来说,重点是注意选择好处理组(treat)与对照组(control)细胞样品,对其分别进行全基因组DNA提取,用于后续WGBS分析研究。
组织样本在进行甲基化研究时,重点需要参考老师的研究课题。由于表观遗传学具有显著的组织特异性,不同组织细胞间甲基化状态可能会有巨大差异:
①在动物组织样本中,若老师主要研究的是某一器官的甲基化水平,最好针对该器官进行取样,注意选取处理组和对照组样本;
②在临床样本中,对临床组织的甲基化研究必须选择相对应的肿瘤组织与癌旁组织(由于人类健康组织样本很难获得,常选用癌旁组织模拟健康样本),或者是肿瘤组织与正常尸检样本;
不建议采用健康人血液作为肿瘤样本的对照,因为肿瘤具有组织特异性,血液样本无此特征,可能无法筛选到特异性差异甲基化基因,目前也几乎没有相关文献采用该种取样方法进行WGBS研究。
由于血液样本不具有组织特异性的特点,在针对某种特异疾病或癌症的研究时,相较于组织样本来说,可能筛选到的差异DMR较少,特异性差,研究针对性弱。若老师选择血液样本进行甲基化研究,患者及健康人样本均需要选取血液样本,不建议将其与组织样本进行对照研究。

点击进行购买咨询
购买咨询© 2023 GENECHEM All RIGHTS RESERVED .
© 2023 GENECHEM All RIGHTS RESERVED .
