Olink蛋白组依托其核心蛋白质检测专利──临近延伸分析(Proximity Extension Assay,PEA),可实现对1-6 μL样本中高达3000多种蛋白质的精确检测。自上市以来备受瞩目,先后获得人类血浆蛋白质组官方推荐、入选“登月计划”肿瘤免疫生物标志物临床试验技术指南方法学第一梯队并获得蛋白质组学研究的推动性技术等诸多殊荣。
PEA使用偶联特异性DNA寡核苷酸标记(DNA barcode)的配对抗体对靶蛋白进行特异性检测。配对抗体识别并结合靶蛋白后,其偶联上的DNA barcode尾端发生互补配对,并被DNA聚合酶识别后延伸,新合成的DNA barcodes通过PCR预扩增后,通过qPCR或二代测序(Next Generation Sequencing,NGS)对DNA barcode的种类和数目进行检测,从而实现对靶蛋白的特异性定量检测。

适用于血浆/血清样本的检测,可用于生物标志物筛选
Olink项目流程包括实验检测和数据分析两大环节。


1. 高认可度,累计发文800多篇,应用广泛

2. 靶向蛋白质组,高灵敏度,低至fg/ml,与质谱技术互补
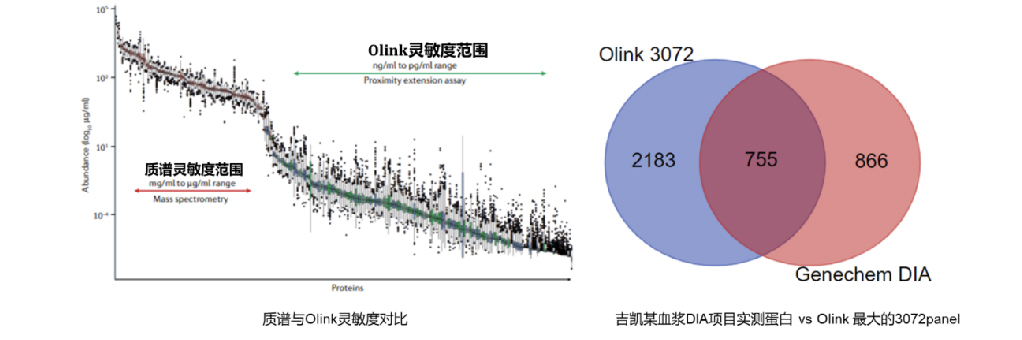
3. PEA双抗体识别技术,高特异性,定量准,与ELISA具有良好的一致性

4. 低至1ul样本量要求,高通量检测以及严格的内部、外部质控设计

1. 丰富的样本处理经验,支持各类科研需求;
2. 严格的质量标准,优秀的技术检测能力;
3. 追求极致的报告体验,提供TOP级期刊生信分析内容,报告解读、数据挖掘视频及中英文方法说明等应有尽有,详情点结果示例;
4. 专业的售前售后服务,及时响应客户消息,全力解决问题。
1. 原始数据质量控制

2. PCA分析
主成分分析(Principal Component Analysis,PCA)是一种统计分析方法,通常用于反映样本的组内和组间差异。PCA图上同组内的样本的聚集程度越高,则表示组内样本的组学特征越相似,即组内样本平行性或重复性越好;而不同组样本分离效果越好,表明组间的组学特征差异越明显。

3. 差异蛋白火山图
火山图(Volcano Plot)直观展示对比组间的差异分布情况。

4. 差异蛋白聚类热图
聚类分析是一种常用的探索性数据分析方法,其目的是在相似性的基础上对数据进行分组、归类。

5. 差异蛋白GO富集分析
GO功能富集分析是通过Fisher精确检验(Fisher’s Exact Test)来发现目标蛋白质群体是否在某些功能类型有显著性的富集趋势。这些被显著富集的GO条目往往涉及到研究者最关心的生物学功能。

6. 差异蛋白KEGG富集分析
KEGG通路富集分析方法与GO富集分析相似,即以KEGG通路为单位,以所有定性蛋白质为背景,通过Fisher精确检验(Fisher's Exact Test),来分析计算各个通路蛋白质富集度的显著性水平,从而确定受到显著影响的代谢和信号转导途径。


期刊: Gastroenterology
影响因子:22.682
发表单位:瑞典奥雷布罗大学的研究团队
发表时间: 2021年7月
一、研究背景
炎症性肠病(IBD),包括2种主要形式:溃疡性结肠炎和克罗恩病,是胃肠道慢性炎症性疾病。目前对于炎症性肠病的早期关键驱动因素的理解以及最终导致不可逆转的炎症的触发因素的了解都很缺乏。瑞典奥雷布罗大学的研究团队利用Olink Target 96炎症panel对早期溃疡性结肠炎的炎症特征进行系统性检测,并找到了一组蛋白具有潜在的溃疡性结肠炎诊断价值。
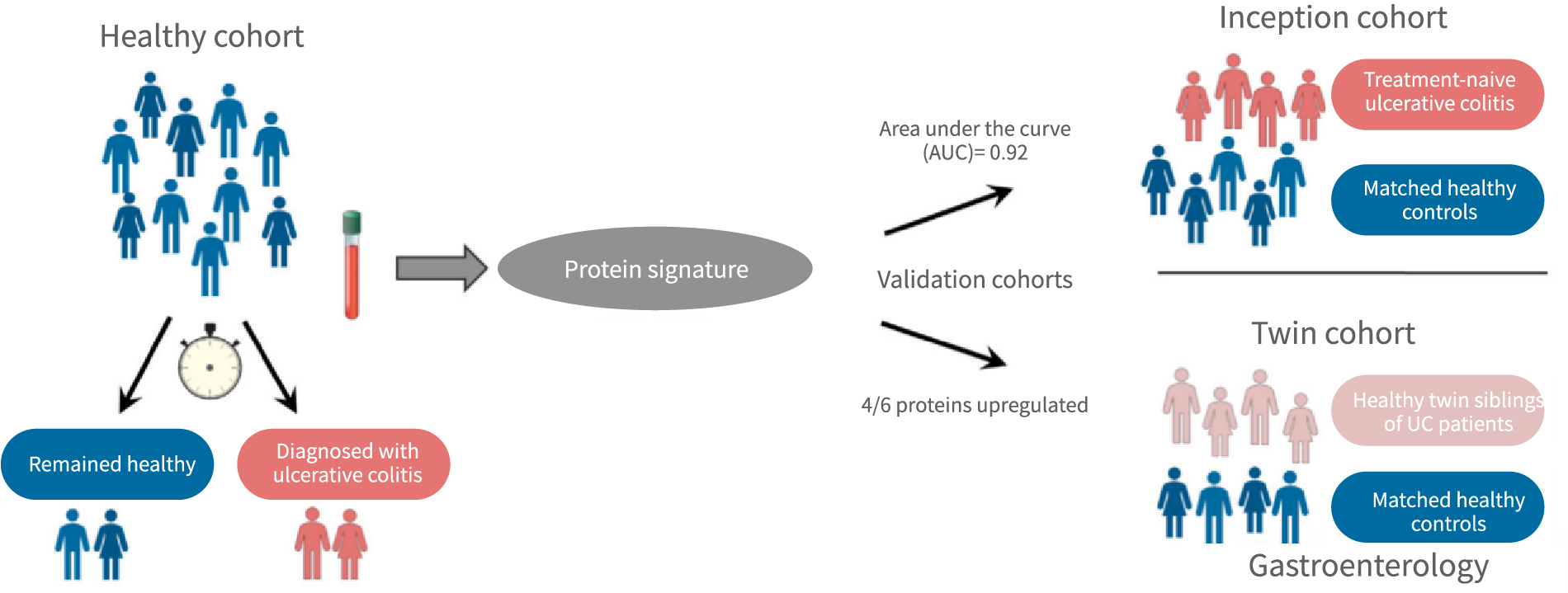
二、研究队列设置
蛋白质组学检测:Olink Target 96炎症panel(检测92个炎症相关蛋白,含细胞因子、趋化因子等)
1.临床前队列(Preclinical cohort)血浆
疾病前组(n=72):当前健康,但在几年后诊断为溃疡性结肠炎(诊断为溃疡性结肠炎的中位时间为4.8年)
健康组(n=140):与疾病组特征相当的健康对照
2.初始队列(Inception cohort)血清
疾病组(n=101):溃疡性结肠炎初期患者
健康组(n=50):与疾病组特征相当的健康对照
3.双胞胎队列(Twin cohort)血清
健康双胞胎(n=37):溃疡性结肠炎患者的健康双胞胎同胞
健康对照(n=41):与健康双胞胎特征相当的健康对照

三、研究结果
1.溃疡性结直肠炎发病前个体的差异蛋白
研究者对临床前队列血浆中的92个炎症相关蛋白进行检测,有27个蛋白在超过80%的样本中低于检测线,因此未被用于后续分析。研究者使用保留的65个蛋白进行PCA分析,未发现疾病前组和健康对照组之间的显著区分。随后,单蛋白逻辑回归模型寻找可区分疾病组和健康组的蛋白,共发现了6个蛋白MCP-1、CXCL9、SLAMF1、CCL11、MMP10和CXCL11在两组间有显著差异。

研究者将同时出现在单蛋白和多蛋白模型中的6个蛋白(MCP-1、CXCL9、SLAMF1、CCL11、MMP10和CXCL11,定义为临床前蛋白标志物)进行后续分析:
(1)检测这6个蛋白预测疾病发生的潜力:单蛋白与溃疡性结肠炎的发生时间没有显著关系;
(2)将每个蛋白在72个群体中的表达情况进行四分位数划分,并根据所在划分位置对每个蛋白在每个个体中赋值1-4;随后计算每个个体中6个蛋白的四分位数划分值总和(范围从6-24)。结果并未找到显著的相关性,即6个蛋白的四分位数划分值总和与溃疡性结肠炎的发生时间无关联。

(3)分析单个蛋白或者6个蛋白的四分位数划分值总和与临床特征如年龄、性别和诊断时疾病的程度之间的相关性。结果显示,除了单蛋白MMP10外,其他单蛋白或者四分位数划分值总和与年龄相关,但与性别及诊断时疾病的程度无关。
2.IPA软件进行炎症通路分析
研究者使用IPA(Ingenuity Pathway Analysis)探索炎症通路及诊断前蛋白的上游调控因子。研究者放宽条件,对多蛋白模型找到的9个蛋白及单蛋白模型中有变化趋势(p<0.1)的蛋白一起进行分析。最终找到的上游调控因子包括IL-4、IL-1β、TNF、IFNγ、NFκB、抑瘤素M(OSM)和IL-6。

3. 5个蛋白可以有效区分疾病组和健康组
研究者对初始队列(Inception cohort)中诊断为溃疡性结肠炎的患者(未经治疗)及健康对照的个体的血清进行Olink Target 96炎症penal检测,并分析差异蛋白。和临床前队列相似,除了MCP-1外,其他5个蛋白(CXCL9、SLAMF1、CCL11、MMP10和CXCL11)均被发现在疾病组中发生了差异调控。研究者使用这5个蛋白进行多因素模型进行留一法((leave-one-out, LOO))交叉验证,以确定这5个蛋白预测疾病的潜能。最终ROC ACU达到了0.92,表明这5个蛋白可以有效地区分疾病组和健康组。

4. 共有的遗传及环境风险因素对临床前蛋白标志物的影响
研究者继续通过比较溃疡性结肠炎患者的健康双胞胎同胞与一般健康个体之间的差异分析了共享遗传和环境风险因素对临床前蛋白标记物的影响。与临床前队列中的发现一致,MMP10,CXCL9,CXCL11和MCP-1在健康双胞胎同胞中上调。这些蛋白标志物均不能区分同卵双生和异卵双生的健康双胞胎同胞。LOO交叉验证预测模型的结果则显示,前述4个蛋白一定程度上可以区分溃疡性结肠炎患者的健康双胞胎同胞和一般的健康个体(LOO AUC=0.62)。

5. 不同队列中蛋白水平差异比较
研究者进一步比较3个不同队列之间的蛋白质差异。临床前队列疾病前组、初始队列疾病组和疾病患者的健康双胞胎同胞组中发现的差异蛋白分别为6个、5个和4个,共有差异蛋白为MMP10、CXCL9和CXCL11。研究者比较了6个临床前蛋白标志物(MCP-1、CXCL9、SLAMF1、CCL11、MMP10和CXCL11)在不同队列中的相对表达情况(每个组别的表达值以该队列的健康对照进行矫正)。结果表明,除MCP-1蛋白外,其他5个蛋白在队列中逐步增加。蛋白在健康对照组的表达水平最低,疾病患者的健康双胞胎同胞组和疾病前组的蛋白表达呈中等水平,溃疡性结肠炎患者组呈现最高的蛋白表达水平。

四、研究总结
研究者通过对溃疡性结肠炎发病前和健康对照的血浆蛋白的比较确定了6种炎症相关蛋白(MCP-1、CXCL9、SLAMF1、CCL11、MMP10和CXCL11))的上调。IPA分析确定了多个潜在的关键调节因子。在初始队列的验证中发现,前述6个血浆蛋白中的5个(CXCL9、SLAMF1、CCL11、MMP10和CXCL11)能有效区分溃疡性结肠炎患者和健康患者,具有潜在的疾病诊断价值。
更多Olink应用案例,可关注吉凯基因微信公众号。
1. 样本寄送流程

注意:所有样本均应标明准确的样本编号,同时配有一张样本登记表,写明样本名称、物种、编号、取样日期、样本处理情况等。
2. 样本寄送地址
上海市浦东新区张江高科爱迪生路332号仓库。
3. 取样原则
(1)代表性原则
取样的代表性关系到实验结果是否具有科学意义,因此您应该根据实验目的慎重选择您的取样方案。
病变组织样本中应不夹带正常组织,正常组织样本中不能含有病变组织。有条件时,应做到实验组与对照组的样本在取材时间、部位、处理条件等方面尽可能保持一致,否则可能会影响实验结果的可信度。
(2)准确性原则
代表性样本的各种特征数据必须被准确记录,并按要求(低温、迅速)采集、制备、贮存、运输,最终正确地按实验设计进行实验和数据处理。
(3)迅速性原则
样本质量是蛋白质组学实验中影响实验结果的最关键因素,因此用于蛋白质组研究的样本,在采集、制备、贮存、运输过程中应尽可能地做到迅速,最大限度的缩短从样本采集到实验的时间。
(4)低温原则
所取样本离体后,应尽快置于液氮(首选)、干冰或-80℃冰箱中,并保证在实验前始终处于-70℃以下,以避免经修饰的蛋白以及低丰度表达的蛋白的降解。
(5)分装原则
为避免样本冻融,建议收集样本的时候对样本进行分装备份,从而保证数据质量的可靠性,检测结果的准确性。
4. 取样要求
|
样本类型 |
样本准备建议 |
样本量 |
样本数建议 |
|
血浆 |
收集全血到抗凝管内 (可选择EDTA,柠檬酸或肝素);在制冷离心机(2-8°C)中以1000-2000g 离心10分钟,取上清,液氮速冻,-80℃ 保存 |
≥50ul |
1.建议实验总样本数为88及88的整数倍,到样即可检测; 2.若样本数不足88例,需与其他项目凑样,凑足88个样本后再检测。 3.凑样项目样本数建议设计成22的整数倍形式 |
|
血清 |
全血在室温下静止15-30分钟(注意放置不宜超过60分钟,时间过长可能易发生溶血);在制冷离心机(2-8°C)中以 1000-2000g 离心10分钟,取上清,液氮速冻,-80℃ 保存 |
5. 样本包装注意事项
(1)在包裹样本的铝箔或冷冻保存管表面,用油性记号笔标明样本编号及样本类型。并且请勿与乙醇等有机溶剂接触。
(2)请勿用纱布、纸张直接包裹样本,而是用铝箔或冷冻保存管包裹后再装入样本袋中。
(3)请勿用玻璃容器在液氮中保存样本;样本包装中请勿使用透明胶带。
(4)请勿把标签纸或其他纸制的说明性文件放入样本袋内,因为纸张在液氮中是易碎的。
(5)标签纸应该贴于样本袋绳上,请勿贴于容器表面以免脱落造成样本混乱。
(6)请勿在一只样本袋中放过多的样本,以防无法放入液氮罐或无法从液氮罐中取出。样本袋在使用前先在液氮中预冷。
(7)在填写《样本登记单》时应当详细描述(临床样本则最好也注明临床病因及所处阶段)样本的类型、处理方法、储存条件以及储存时间等相关细节,以便技术人员确定合理的实验方案。
6. 样本储存注意事项
(1)细胞样本收集好后,立即放入-80℃保存。
(2)组织样本采集后,样本迅速放入进口高质量冻存管中,拧紧后立即放入液氮。然后再转移到-80℃中保存。
(3)组织样本储存于液氮或-80℃冰箱中。对于液氮保存样本,务必注意,不要用Eppendorf管和国产冻存管,因为这些管子从液氮中取出时极易发生管子爆裂而造成样本损失。
7. 样本运输注意事项
(1)飞机运输干冰上限约为2公斤,超过2公斤原则上不能运输。火车运输不受限制。
(2)干冰运输应采用壁厚且质量完好的泡沫箱,材料用编号后的冻存管存放,用塑料袋包装后埋入干冰中,泡沫箱应扣严并用封箱带封严。外套纸壳箱包装,以免碰裂。并标明轻取轻放提示,以保证安全运输。
(3)运输时可在干冰上再放一排液体冰袋。
(4)如委托快递运输,运输过程中应随时跟踪货物的情况,记录货单号,并保持与发出地和接收地的快递公司的联系。

点击进行购买咨询
购买咨询© 2023 GENECHEM All RIGHTS RESERVED .
© 2023 GENECHEM All RIGHTS RESERVED .
