翻译组测序是指对与核糖体结合的正在翻译的RNA片段进行测序,来准确获取样本中所有可翻译分子(包括mRNA和其他潜在可翻译RNA分子如lncRNA, circRNA等)的信息与精确定量,是连接转录组与蛋白质组之间的桥梁。
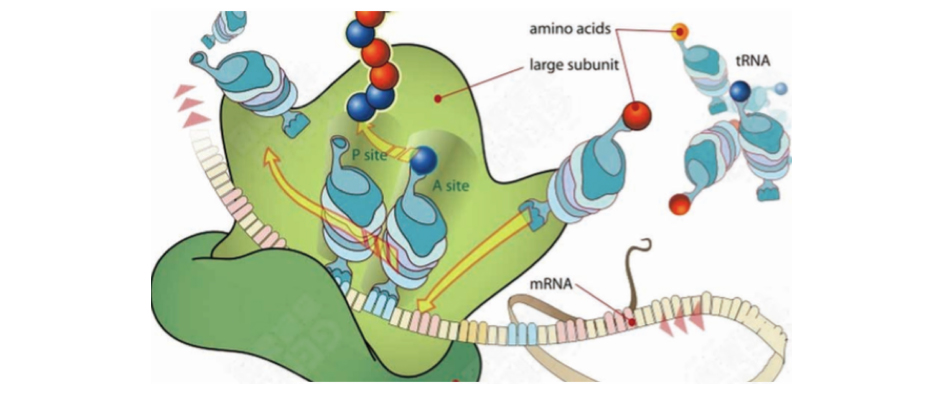
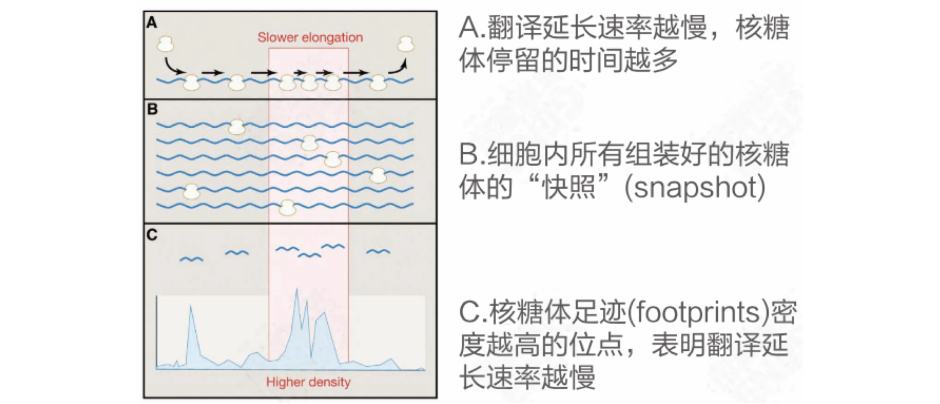
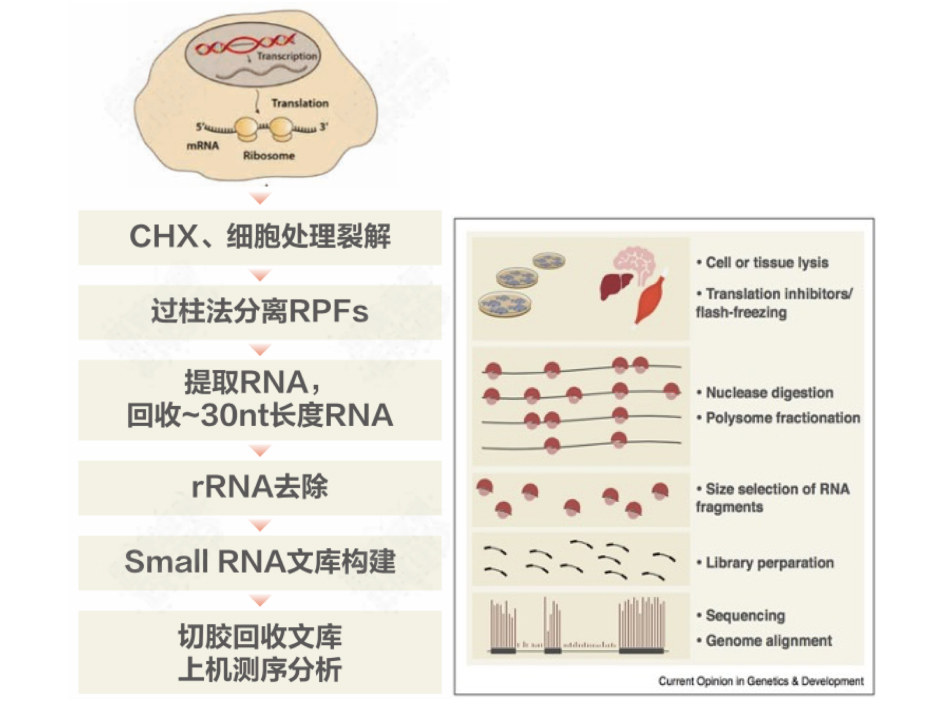
Ribo-seq (Ribosome profiling sequencing)是最常用的一种翻译组测序技术,该技术利用RNA酶消化细胞中的RNA,得到被核糖体保护的正在翻译的RNA片段(ribosome footprints, RFs),然后对这些被核糖体保护的30nt左右的RNA片段进行富集、深度测序、分析。
翻译组测序可以研究细胞内基因翻译的水平、区域、速率等,结合转录组、小RNA测序、蛋白组等进行关联分析,可以更精确地研究转录后调控、翻译调控机制。

两组以上的实验,可对差异基因集进行聚类分析,将表达模式相近的基因聚在一起,这些基因可能具有共同的功能或参与到共同的代谢途径及信号通路中。我们采用主流的层次聚类对基因表达值进行聚类分析,对表达数据的行进行均一化处理。
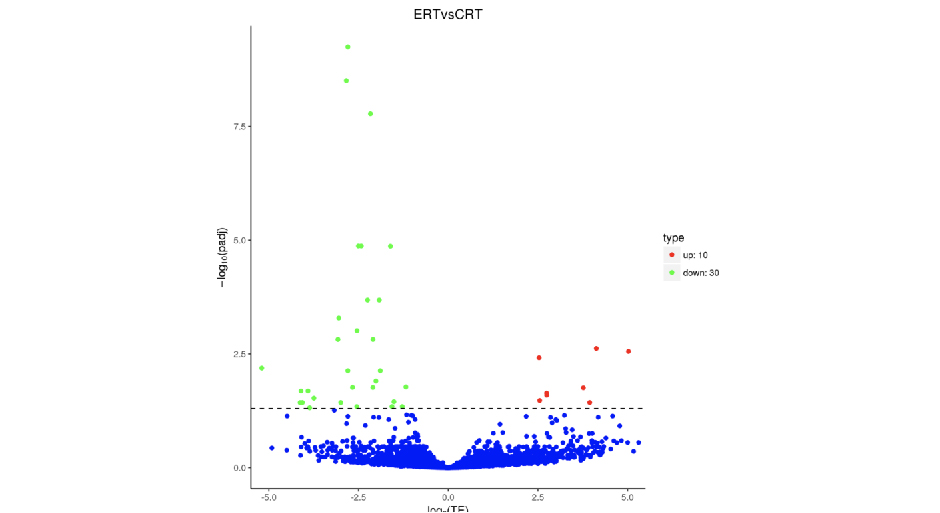
火山图可直观展示每个TE比较组合的差异基因分布情况,如下图所示。图中横坐标表示基因在处理和对照两组中的表达倍数变化(log2FoldChange),纵坐标表示基因在处理和对照两组中表达差异的显著性水平(-log10padj或-log10pvalue)。
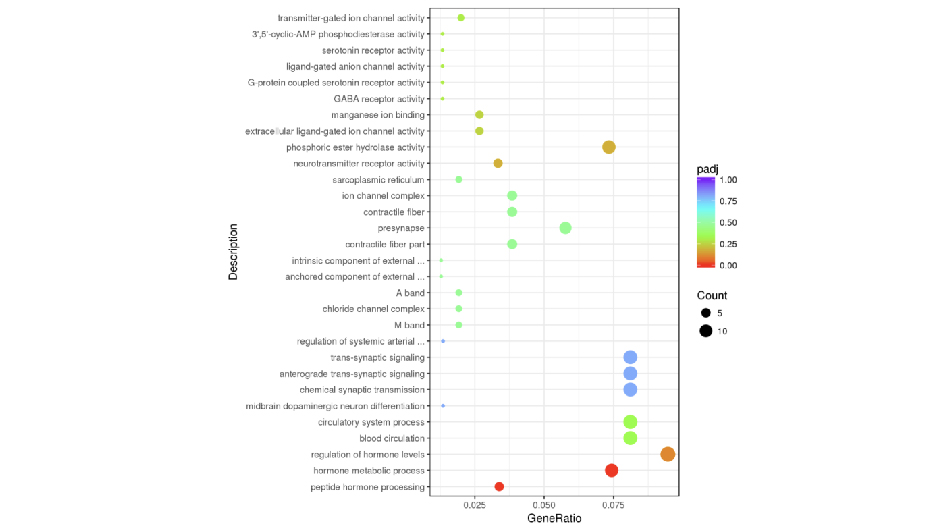
GO(Gene Ontology)是描述基因功能的综合性数据库,可分为生物过程(biological process)和细胞组成(cellular component)分子功能(Molecular Function)三个部分。从GO富集分析结果中,选取最显著的30个Term绘制柱状图进行展示,若不足30个,则绘制所有Term,如下图所示。
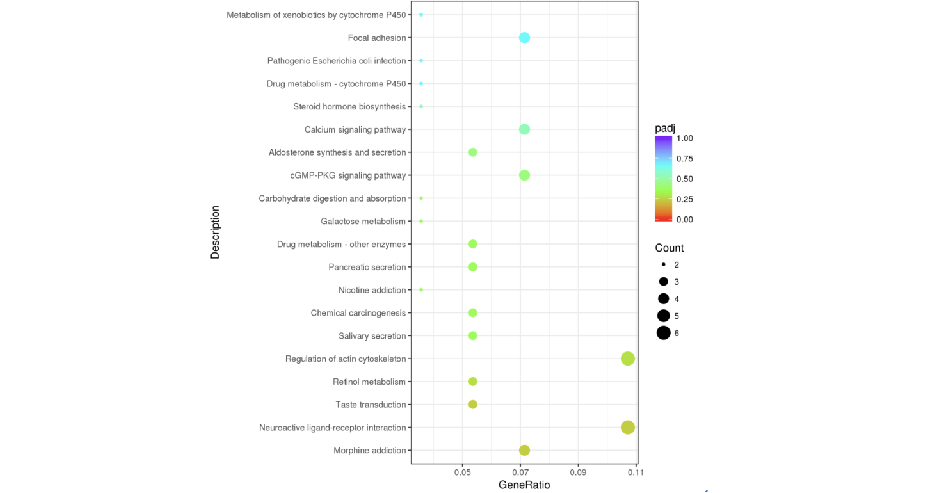
KEGG(Kyoto Encyclopedia of Genes and Genomes)是整合了基因组、化学和系统功能信息的综合性数据库。从KEGG富集结果中,选取最显著的20个KEGG通路绘制散点图进行展示,若不足20个,则绘制所有通路,如下图所示。
样本量
|
|
Ribo-seq翻译组测序 |
|
细胞样本 |
|
|
组织样本 |
采样方法
一、贴壁细胞样本
1. 使用 15cm2 培养皿培养的贴壁细胞,细胞浓度应为 5×106-5×107/ ml。吸出培养基,加入新鲜培养基(含放线菌酮,终浓度 0.1 mg/ml),孵育 1min;
2. 吸出培养基并将细胞置于冰上。用 10ml 预冷的PBS(含放线菌酮,终浓度在 0.1mg/ml)轻轻冲洗一次,吸干液体;
3. 再加入 1-2 ml 预冷的 PBS(含放线菌酮,终浓度 0.1mg/ml),侧拿皿,使之一定程度倾斜,用一次性细胞刮刀轻轻刮下细胞,刮的时候顺一个方向转着刮,集于底侧;
4. 用1ml枪头吸净置预冷1.5mlEP管内(一次吸不完可离心弃上清后再吸);
5. 已预冷的4°C离心机离心收集细胞,500g离心5min,弃上清,收集细胞;
6. 液氮速冻。-80°C 暂存,干冰运输;
7. 按照以上处理方式准备5x107细胞;
注意:放线菌酮为剧毒化合物,操作时注意做好防护,处理后残余物不要随意丢弃。
二、悬浮细胞
1. 取 5×106-107 的细胞,500rpm离心5min,弃上清;
2. 加入新鲜培养基(含放线菌酮,终浓度0.1mg/m),轻柔吹吸混匀,500rpm离心5min,弃上清;
3. 加入1ml预冷的PBS(含放线菌酮,终浓度0.1mg/ml),轻柔吹吸混匀,转移至预冷1.5ml EP 管内,500rpm 离心 5min,弃上清;
4. 500g,4°C,离心 5min,弃上清,收集细胞;
5. 液氮速冻。-80°C 暂存,干冰运输;
6. 按照以上处理方式准备5x107细胞。
三、组织样本
1. 动物组织取材后用预冷的 RNase-free 水冲洗,去除血渍和污物,并剔除非研 究所需的组织,吸干水渍;
2. 冰上操作,将组织切小块(厚度小于 0.5cm),放入已标记好的旋盖冻存管中, 迅速浸入液氮中速冻至少1小时,然后保存于-80°C冰箱,以避免实验操作前样本降解的可能性;干冰运输;
3. 为确保实验的顺利,建议样本备份1-2份,每份>200mg,以防备部分样品 降解重新取材,制备或送样;
4. 按照以上处理方式准备至少300mg的组织。
注意事项
Ribo-seq 翻译组测序要计算翻译效率需要同时做转录组;
转录组送样请另外按照转录组送样要求进行样本的准备,不可使用同一管样本建库;
Ribo-seq 翻译组和 RNA-seq 转录组需要分开送样。

点击进行购买咨询
购买咨询© 2023 GENECHEM All RIGHTS RESERVED .
© 2023 GENECHEM All RIGHTS RESERVED .
