2021-08-05
2013年,张锋教授在他的实验室开发出创新性CRISPR/Cas9系统,大幅度提高了编辑基因的可靠性和效率,基于CRISPR的基因操作工具彻底改变了靶向与疾病相关的基因的能力,颠覆了科研界的基因研究策略,迅速成为生命科学研究领域最火热的技术。
2014年,张锋教授又构建了针对人类将近2万个基因,包含120000多条sgRNA的CRISPR KO文库,在细胞上进行全基因组耐药基因的筛选,在Science上发了篇文章;第二年,换了个CRISPR SAM过表达的文库进行筛选,又在Nature上发了篇文章,最近几年,更是研究出各种升级换代的CRISPR 基因编辑系统,总之是个引领科研潮流的男人没错了!而张锋教授共享出来的CRISPR KO/SAM文库,许多优秀的科学家将这个强大的基因筛选工具应用到自己的研究当中,产出了许多高分高质量的文章。
今天就和各位分享天津医科大学总医院康春生教授课题组、首都医科大学天坛医院江涛教授以及天津医科大学吴旭东教授合作新鲜出炉的一篇关于CRISPR CAS9 KO文库筛选的文章。文章发表在Advanced Science(IF=15.804)。

康教授、江教授和吴教授团队研究的是胶质瘤,胶质瘤是一种侵袭性很高的脑内肿瘤,而且在经过手术后化疗或放疗后复发率高。EGFR是胶质瘤发生的一个重要驱动基因,而EGFRvIII是一个常见的EGFR突变,可在30%的胶质瘤患者中被检测到,EGFRvIII不能结合任何配体,但是其酪氨酸激酶活性一直维持着激活的状态,而该突变也被报道在多种肿瘤中与放化疗耐受相关。那么是不是有可能找到破坏细胞耐药的基因呢?
因此康教授、江教授和吴教授团队与吉凯基因转化医学研究院开展合作,利用CRISPR-CAS9 KO文库在过表达EGFRvIII的 U87-EGFRvIII 和 U87 wt细胞中进行TMZ耐受相关基因筛选与分析,该文库包含123 411条sgRNA,可靶向19050个编码基因和1864个miRNA。
首先在U87-EGFRvIII 和 U87 wt细胞中感染KO 文库,再分别给与溶剂DMSO和药物TMZ,分别在7天和14天的时候收集细胞,进行sgRNA建库测序,检测各sgRNA丰度变化。测序结果分析显示,在U87-EGFRvIII细胞中,7天TMZ处理组与溶剂处理组相比,有1287个基因与TMZ耐受相关,14天TMZ处理组与溶剂组相比,有1287个基因与TMZ耐受相关。
另外,对U87-EGFRvIII 和 U87 wt进行TMZ处理比较,发现有981个基因与TMZ耐受相关基因,和929个基因与TMZ敏感相关基因。
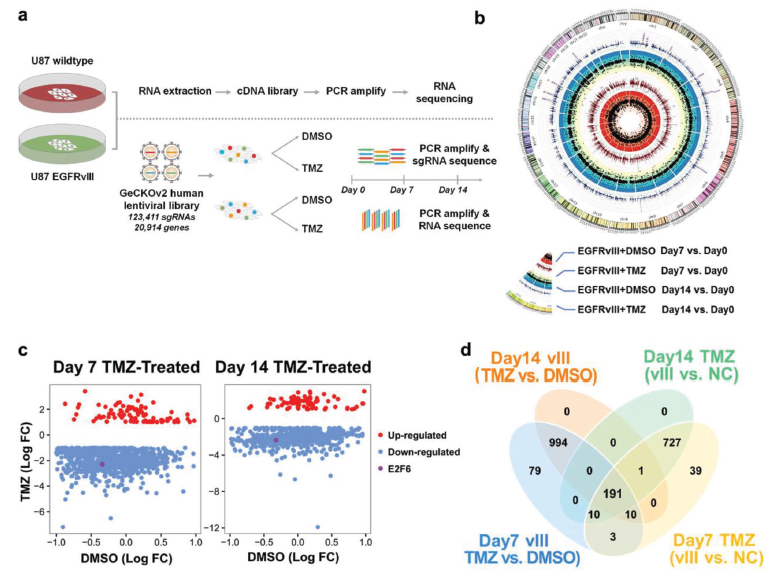
对这4组基因中的共同的191个显著差异基因进行KEGG分析,发现该群差异基因主要富集在剪接体、核糖体和细胞周期通路上。通过Ingenuity pathway analysis (IPA)的分析U87-EGFRvIII 和 U87 wt细胞组间的差异基因,富集的通路为CD28通路、NF-κB通路,NFAT通路等。作者还根据IPA分析结果对EGFRvIII 突变的GBM细胞产生TMZ耐受的可能机制作了模拟示意图。
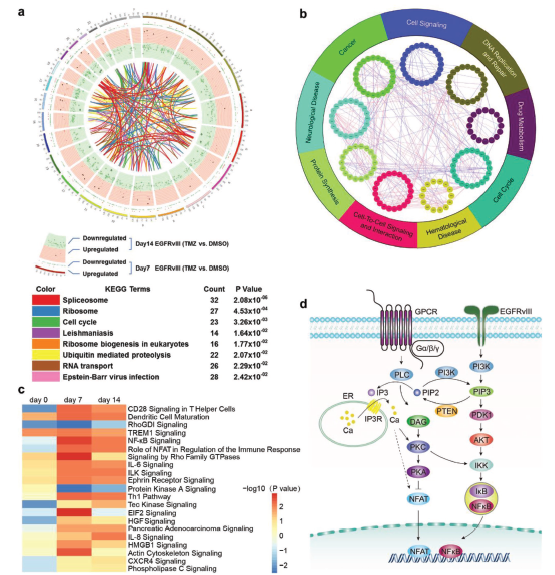
那么究竟在这么多的差异基因中,到底哪些基因才真正具有抑制EGFRvIII表达细胞的TMZ耐受作用,作者又进一步对U87wt 和U87-EGFRvIII细胞进行了RNA-seq转录组表达检测,发现有19个基因在U87-EGFRvIII细胞中显著高表达。同时,又对U87wt 和U87-EGFRvIII细胞分别给与溶剂和TMZ处理,对细胞样本进行RNA-seq检测。结合之前的KO 文库筛选数据,E2F6这个基因是唯一一个既在文库筛选时,敲除后能增强TMZ对细胞的杀伤,同时又在U87-EGFRvIII细胞中高表达,且会被TMZ诱导高表达的基因。说明E2F6可能是一个重要的TMZ耐受相关基因。
TCGA的数据以及Rembrant数据显示E2F6在胶质瘤中的表达与胶质瘤分级显著相关,且在胶质瘤经典亚型中的表达显著高于PN型和MES型。作者还进行组化实验验证了以上数据库的结果。而利用TCGA数据库中胶质瘤的RNA-seq数据,分析与E2F6表达相关的基因,并进行KEGG分析,发现这些基因显著富集到细胞周期和DNA修复通路上。
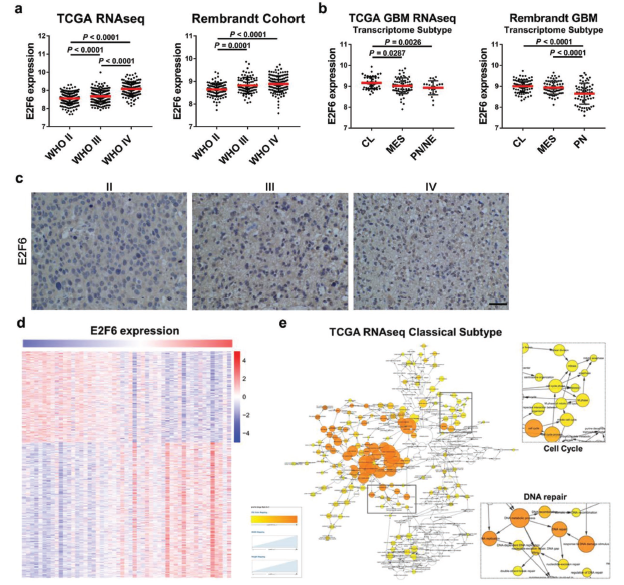
找到了潜在的关键耐药基因,还验证到该耐药基因E2F6在胶质瘤中有显著临床相关性,那么后面就是比较常规的对E2F6的功能和机制进行验证分析。
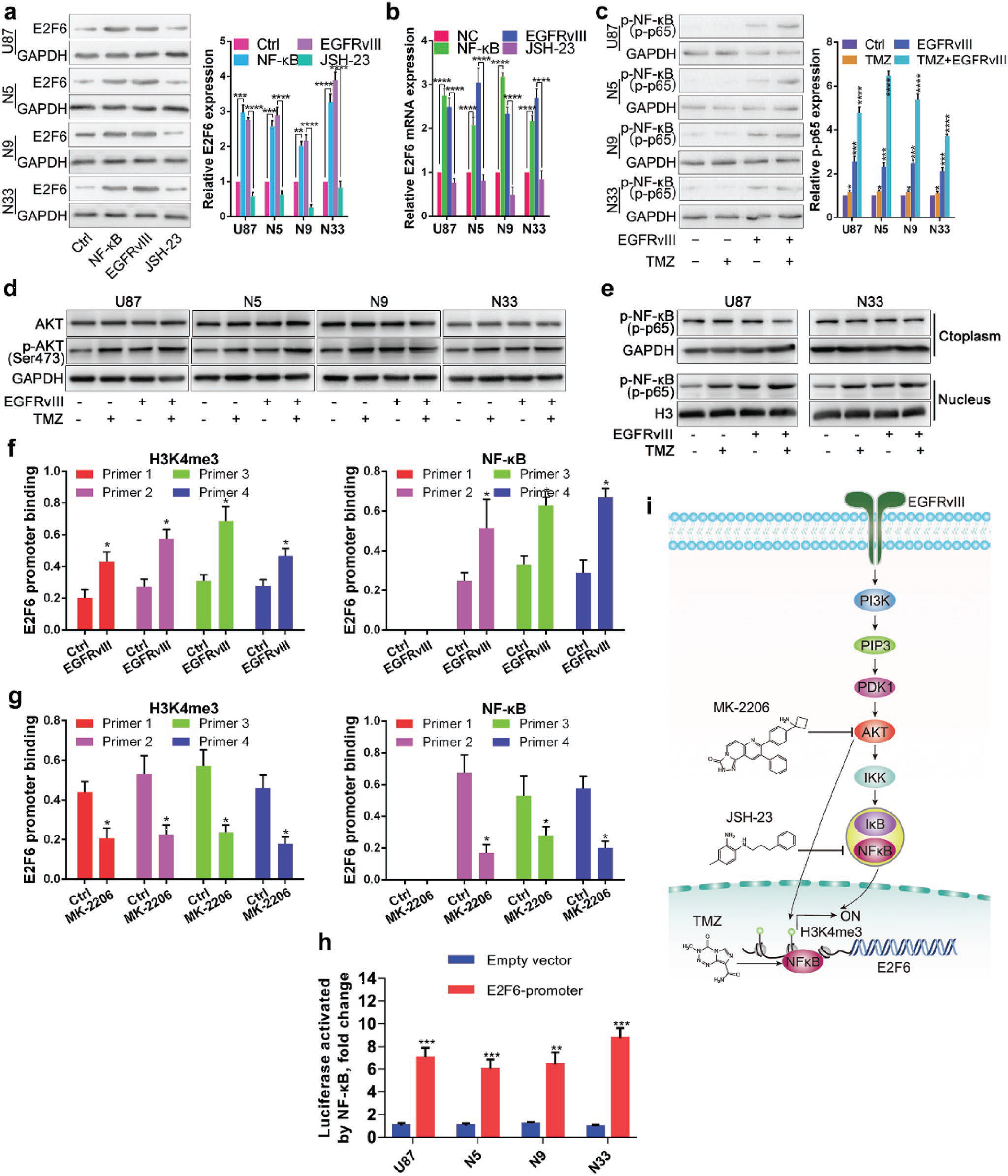
首先,在常见的几株胶质瘤细胞株上,过表达EGFRvIII,再给与TMZ处理,发现E2F6的表达显著增加。而在EGFRvIII过表达和对照组细胞中,去干扰和过表达E2F6,会分别导致细胞对TMZ耐受减弱和增强。EGFRvIII介导的放化疗耐受通常与DNA双链断裂(DSBs)损伤修复相关,那么E2F6是否可能也是由于增强了DSBs损伤修复从而导致的EGFR耐受呢?为了验证这一问题,作者对细胞进行了γ-H2AX的免疫荧光检测,过表达E2F6或者EGFRvIII显著减少了TMZ引起的DSBs,而干扰E2F6可消除EGFRvIII对TMZ引起的DSBs修复作用。除DNA损伤修复之外,肿瘤干细胞也是引起化疗耐受的一个关键因素,而作者发现E2F6在神经球胶质瘤细胞中显著高表达,且在EGFRvIII过表达的胶质瘤细胞中干扰E2F6后,会抑制细胞的成球能力。

进一步实验结果显示EGFRvIII和TMZ可激活Akt通路以及NF-κB通路,促进p-NF-κB的核转运。而在EGFRvIII过表达的细胞中运用AKT抑制剂以及NF-κB通路激动剂处理,发现E2F6的表达与NF-κB通路激活呈正相关。作者运用ChIP-PCR实验和Luciferase验证了,在EGFRvIII过表达组,E2F6的启动子区富集结合了H3K4me3和p-NF-κB,而阻断AKT通路可抑制这个富集现象。以上结果说明E2F6的表达受EGFRvIII/PI3K/AKT/NF-κB 通路调控。
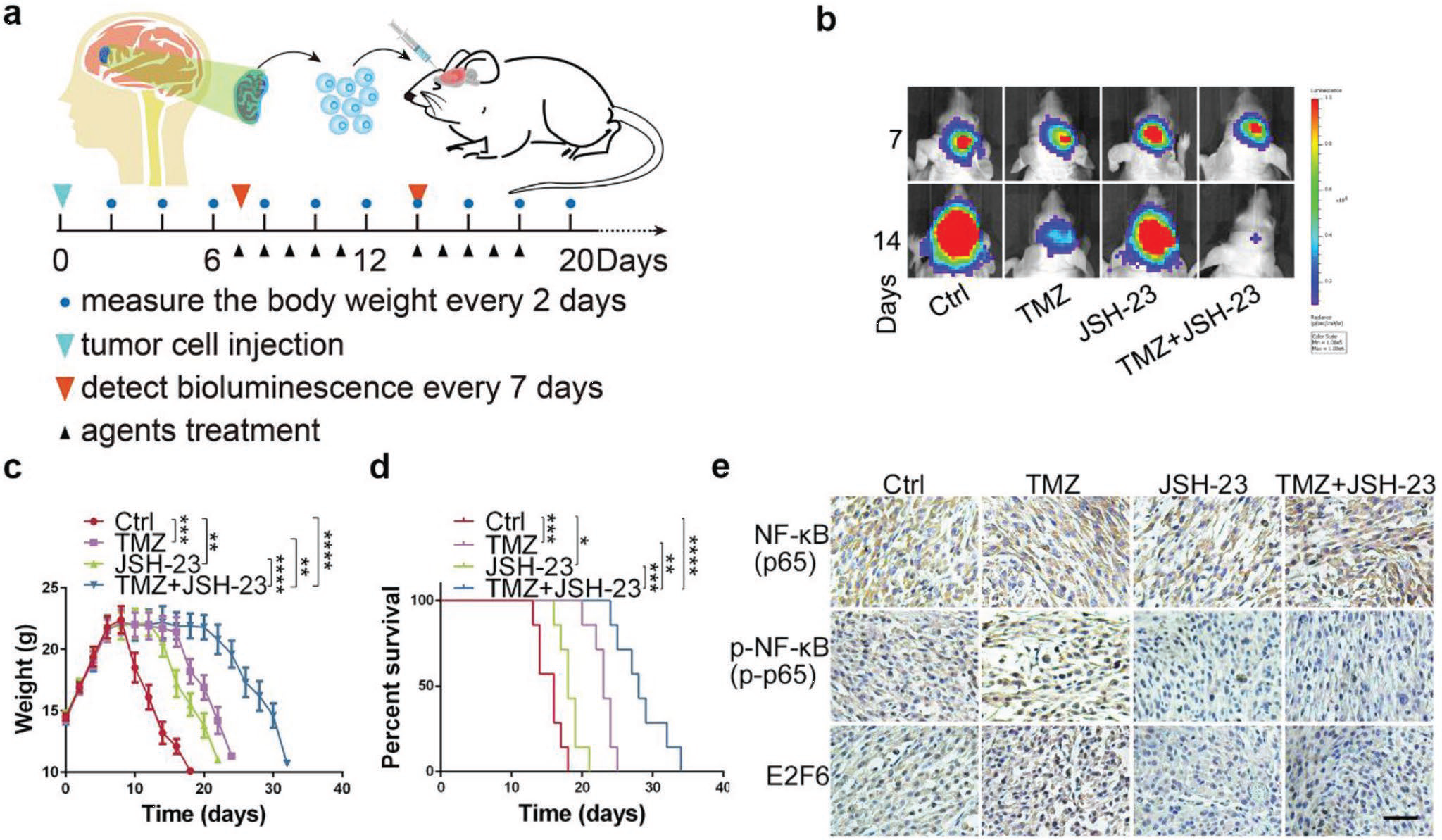
另外,在动物体内实验中,作者在U87细胞中过表达E2F6,在U87 EGFRvIII细胞中干扰E2F6,与分别的对照组细胞进行裸鼠颅内注射,进行原位瘤模型构建,并在1周后开始给与TMZ,活体成像结果显示,U87/E2F6 OE组对TMZ产生了耐受,U87EGFRvIII/E2F6 siRNA对TMZ治疗敏感,而U87 TMZ处理组和U87EGFRvIII/E2F6 siRNA组小鼠有更长的生存期。但在TMZ处理组中,尤其是U87/EGFRvIII/E2F6 siRNA组小鼠体重下降更多。瘤内的信号通路分子变化也与细胞水平上一致。说明抑制E2F6是一个潜在的能够有效解决胶质瘤TMZ耐受的治疗策略。

由于目前没有小分子抑制剂可以特异性抑制E2F6,因此作者了运用E2F6上游通路的p-AKT 抑制剂 (MK-2206)和NF-κB 抑制剂 (JSH-23) ,与TMZ进行联合,检测联合药物对GBM细胞的杀伤,在细胞学水平,两种抑制剂和TMZ联用都显示出协同杀伤作用。这种联用作用在体内水平是否同样有效?作者收集了临床上一例接受手术治疗以及三个疗程TMZ治疗后又复发的患者样本,构建了PDX动物模型,分别给与对照PBS给药、TMZ给药、JSH-23给药以及TMZ/JSH-23联合给药。PDX动物的活体成像显示,联合用药组的肿瘤抑制作用最为明显,同时对小鼠的体重影响最小,生存期也最长。
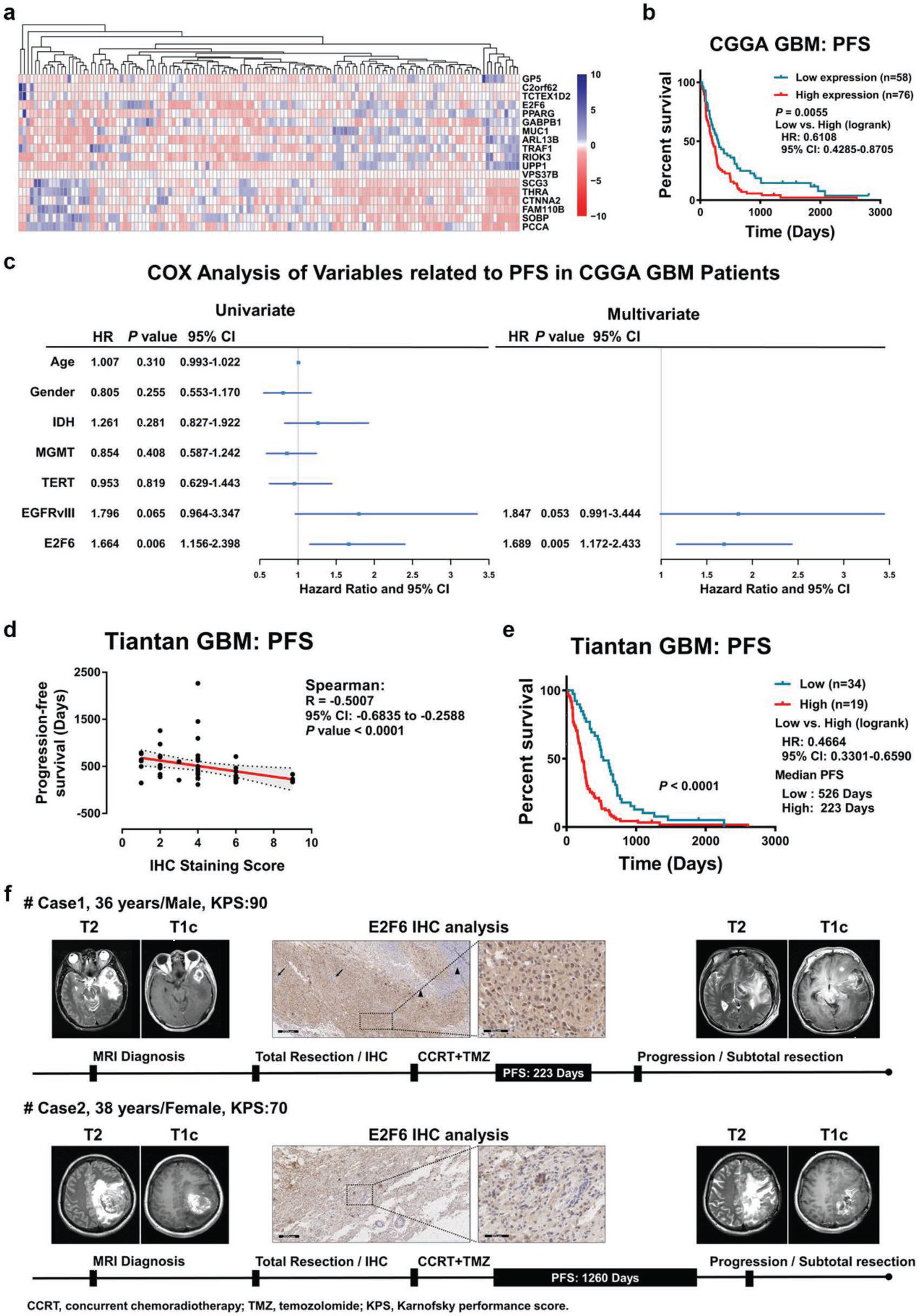
最后,作者获取了中国胶质瘤基因组图谱Chinese Glioma Genome Atlas (CGGA)中,有无进展生存期(PFS)数据的134胶质瘤患者样本的RNA-seq数据,分析在CRISPR CAS9 KO文库筛选阶段筛选到的191个显著差异蛋白,其中有18个基因与PFS相关,其中高表达的E2F6与更短的PFS相关。对北京天坛医院的53例接受标准治疗的原发胶质瘤患者进行分析,也发现E2F6的表达与患者的无进展生存期呈负相关。以上结果说明E2F6可作为GBM的一个不良预后biomarker。
最后总结一下,康教授、江教授和吴教授团队运用CRISPR CAS9 KO文库在过表达EGFRvIII的细胞中筛选与TMZ耐受相关的基因,再结合EGFRvIII过表达和对照组,TMZ处理组和对照组的转录组测序,找到一个与TMZ耐受高度相关的基因E2F6,针对E2F6的临床相关性、功能和作用机制进入深入的分析验证,运用原位成瘤模型和PDX模型验证E2F6敲低以及E2F6上游通路的抑制剂与TMZ联用,可有效抑制肿瘤的生长,证明E2F6是一个潜在的解决TMZ耐受的关键靶点基因。
论文中的所使用的高质量CRISPR CAS9文库及建库测序和相应部分的生信分析由吉凯基因转化医学研究院和康教授、江教授和吴教授团队合作完成。
© 2023 GENECHEM All RIGHTS RESERVED .
© 2023 GENECHEM All RIGHTS RESERVED .
