RNAi的稳定细胞株,虽然在RNA水平因为siRNA的存在会一直保持较好的被抑制率,但是蛋白水平的抑制作为siRNA作用的副产物,同时受到细胞内其他复杂机制的调控。在稳定细胞株中,被抑制的蛋白产物可能通过其他的补偿机制逐渐恢复了其表达水平。因此建议采用可诱导表达的RNAi稳定株进行实验。
AAV感染细胞MOI会非常高,可能从几千到几十万不等,而且与其他病毒相比,AAV在细胞实验中的MOI不稳定。虽然有可以做细胞的血清型DJ型,但是DJ型的感染效果不如慢病毒,因此细胞实验建议选择慢病毒。
hsyn:神经元特异启动子;
GFAP:星形胶质细胞特异启动子;
Ubiquitin:一种常用的组成型启动子。
IRES:内部核酶进入位点,起到连接两个基因,在一个启动子驱动下转录的作用。IRES连接的两个基因不会融合表达,IRES的RNA可以招募核糖体,翻译下游基因,但是IRES是一种再招募的过程,其后基因的mRNA的翻译量低于自身mRNA的数量,所以表达偏低,因此一般在IRES后加抗性蛋白,而不加荧光蛋白。
WPRE:WPRE元件可通过转录后调控机制增强目的基因表达。
CMV bGlobin:指的是在CMV启动子序列中增加bGlobin的一个内含子,增强转录后RNA加工调控,增加表达水平,从而增强启动子的表达能力。
FLEX、DIO、double floxed:都是CRE-ON表达系统,只是写法不一样;AAV常见滴度在1E+12-13 v.g./ml左右。
慢病毒纯化工艺,依据其纯化原理主要分为超速离心、密度梯度离心、PEG离心、超滤、切向流、离子交换层析等方法。当前主要的慢病毒纯化均是由上述中的一种或几种方法组合在一起完成。
对于大部分的细胞感染以及普通的动物实验来说,我们推荐使用超速离心方法对慢病毒进行浓缩。超滤过程中留下的细胞碎片会导致细胞毒性,直接影响病毒的应用。
|
|
病毒上清/粗纯病毒 |
科研级慢病毒 |
科研+级慢病毒 |
临床级慢病毒 |
|
纯化方法 |
无/超滤 |
超速离心 |
切向流+超速离心 |
切向流+蛋白纯化+离心 |
|
纯度 |
极低 |
较高 |
高 |
极高 |
|
总DNA残留 |
较高 |
≤10μg/ml |
≤1μg/ml |
≤100pg/ml |
|
总蛋白残留 |
较高 |
≤200μg/ml |
≤100μg/ml |
≤80μg/ml |
|
BSA残留 |
较高 |
≤10μg/ml |
≤1μg/ml |
≤200ng/ml |
|
滴度 |
滴度较低且不稳定 |
≥1E+8TU/ml |
≥1E+9TU/ml |
≥2E+8TU/ml |
|
工艺复杂度 |
操作简单 |
操作较简单 |
操作比较复杂 |
操作复杂,严格,耗时长 |
|
应用方向 |
易感染的永生化细胞系,不适合原代细胞或干细胞等敏感细胞 |
绝大多数永生化的细胞系,原代细胞、干细胞、动物实验 |
对外源刺激极度敏感的细胞及动物实验 |
临床前及临床研究 |
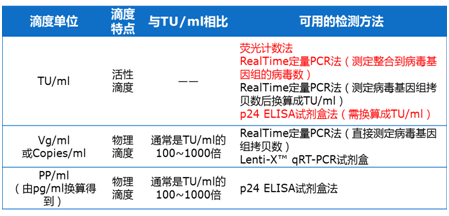
常用检测方法如下:
质粒和慢病毒、腺病毒、腺相关病毒等病毒类是常见的基因操作工具。质粒表达时间快,导入细胞后约24小时就可以观察到目的基因的表达,并且构建简单,成本低。但质粒转染时需要借助转染试剂,该试剂有细胞毒性;大部分细胞用质粒转染时转染效率低,无法进行基因操作;此外,质粒只能用于瞬时表达,对于观察周期较长的实验,无法用质粒进行操作。
而上世纪80年代发展起来的病毒工具转导效率比真核表达载体高很多,特别适合于介导外源基因在难转染甚至无法转染的细胞中表达。常用的基因操作病毒工具有慢病毒、腺病毒和腺相关病毒等。
|
|
|
|
|
了解了这些病毒载体的优势和不足后,如何根据实验目的来挑选合适的基因操作工具呢?建议您可以从以下这几个方面出发:
1.工具载体的表达时间与实验观察时间是否相符;
2.工具载体可以容纳的片段大小与目的基因大小是否契合;
3.工具载体对目的细胞、在体组织的转导是否足够高效。
|
|
质粒 |
慢病毒 |
腺病毒 |
腺相关病毒 |
|
外源基因表达时间 |
24h开始表达 持续3-7天 |
2-4天开始表达 |
1-2天开始表达 持续7-14天 |
7-14开始表达 细胞分裂不旺盛部位可长时间表达 |
|
插入片段大小 |
< 5~8kb |
<4kb |
< 5~8kb |
<2.8kb(包括必须的启动子以及荧光或者标签元件) |
|
稳定细胞株 筛选 |
可以,但较难操作 |
可以,外源基因整合于宿主基因组,筛选简单 |
不可以,瞬时表达外源基因传代后效果减弱 |
不可以 |
|
细胞实验 |
细胞系,部分细胞转染效率较低 |
首选,广谱,感染效率高 |
广谱,感染效率高,适合原代非增殖细胞感染 |
不适合细胞实验 |
|
动物实验 |
不适合 |
适合,根据观察时间和注射部位选择 |
较适合(免疫原性高),根据观察时间和注射部位选择 |
首选,根据观察时间和注射部位选择 |
|
滴度 |
无 |
最高可达109TU/ml |
高达1012pfu/ml |
高达1012~13v.g/ml |
常见基因操作工具选择指南
光遗传蛋白经过多年的发展,激活型和抑制型蛋白均发展出几种不同的突变型,可以根据自己的激光器和实验需求进行选择,一般我们选择突变型光遗传蛋白,这些突变体可以产生更强的光电流,下面是一些常见的光遗传蛋白,可以根据自己的需要选择。
激活型通道蛋白:
1. ChR2(H134R):ChR2的突变体,将第134个氨基酸由组胺酸突变为精胺酸,该蛋白质可以产生两倍的光电流,但通道开关速度也比野生的ChR2慢了一倍。该突变体是运用最广的一种类型。
2. ChR2(C128S/D156A): ChR2的突变体,超灵敏光敏感通道,用蓝色激光打开通道,然后用绿色或黄色激光关闭通道,可以打开其离子通道长达30分钟;
3. ChR2(E123T/T159C): ChR2的突变体,更大的光电流和更快的动力学变化;
4. ChETA:ChR2的突变体,使得神经元在激光刺激下可以发放200Hz的spike,而其他的ChR2通道蛋白只能达到40Hz;
5. C1V1:由ChR1及由团藻发现的VChR1组合在一起的通道蛋白,在红色激光刺激下打开通道,该通道蛋白类型更利于双光子激发;
6. ReaChR:能在大脑深处或透过头盖骨激活。
抑制型通道蛋白:
1. NpHR:即为Halorhodopsin,第一个有效抑制神经元活动的光遗传学工具,在黄绿激光照射下会将氯离子打进神经元内,而抑制神经元活动。当把NpHR表达在哺乳动物脑内时,会聚集在内质网上,而如果将内质网输出元件加在NpHR基因序列后面,这样可以使得NpHR在胞内高量表达,而且不会聚集在内质网上,这样修改过的NpHR被称为eNpHR2.0。但是eNpHR2.0在细胞膜的聚集仍然不够,而将一个高尔基体输出元件和来自于钾离子通道Kir2.1的上膜元件加在eNpHR2.0基因序列后面,这样就能实现在神经元细胞膜上的高量聚集,这样修改过的NpHR被称为eNpHR3.0;
2. Arch:即为archaerhodopsin,是一种黄色激光激活的外向整流质子泵,能够将带正电的质子从神经元内移动到细胞外环境中,使神经元处于超极化状态,从而保证神经元处于静息状态。在特定条件下,可用于增加细胞内pH或减少细胞外基质pH。和NpHR相比,当激光关闭的时候,Arch立即从通道打开状态恢复到关闭状态。
3. Mac:即为Leptosphaeria maculans fungal opsins,蓝色激光激活的质子泵,能够将带正电的质子从神经元内移动到细胞外环境中,使神经元保持超极化状态,从而保证神经元处于静息状态。您有什么要咨询的吗?
点击咨询致力转化医学,赋能新药创制
您有什么要咨询的吗?
© 2023 GENECHEM All RIGHTS RESERVED .
© 2023 GENECHEM All RIGHTS RESERVED .
