2021-07-08
研究中构建多种稳定转染细胞株的慢病毒LV-HBx、LV-ARRB1、LV-ARRB1-shRNA(GV112载体),及监测自噬水平的荧光双标慢病毒stubRFP-sensGFP-LC3均由吉凯基因提供,实现高效稳定的基因过表达或敲低。
目前在我国乃至全球,乙肝仍然是一个严峻的健康挑战,其导致的肝癌发病率及死亡率均位居全球前列,因此乙型肝炎病毒(HBV)感染导致的乙肝相关性肝癌一直是威胁健康的重要杀手。虽然乙肝抗病毒药物的应用能有效抑制病毒的复制,但由于病毒DNA整合于宿主染色体导致病毒DNA的持续复制,特别是Hepatitis B virus X protein (HBx)的持续表达,是导致乙肝相关性肝癌发生发展的重要机制。HBx是乙型肝炎病毒X基因编码的一种多功能蛋白。尽管HBx分子量很小,功能却复杂多样,具有广泛的转录激活作用,参与了众多重要的生物学过程的调控,并促进肝细胞癌的发生和发展。
2021年4月18日,中山大学附属第三医院消化内科吴斌教授研究团队在自噬领域专业期刊《Autophagy》(2020年影响因子16.016)在线发表了题为“HBx induces hepatocellular carcinogenesis through ARRB1-mediated autophagy to drive the G1/S cycle”的研究论文。该研究阐明了乙肝相关性肝癌癌变过程中的新机制,为乙肝相关性肝癌的防治提供了重要的理论依据及潜在的治疗靶点。

该研究团队一直致力于乙肝相关性肝癌发病机制及临床防治研究,既往研究已揭示β-arrestin1 (ARRB1)通过调控Akt信号通路在肝细胞癌变中发挥重要作用(Nature Communications. doi: 10.1038/ncomms8369)。在此基础上,研究人员通过对160名HBV相关肝细胞癌(HCC)患者的肝癌和癌旁组织免疫组织化学染色分析,发现ARRB1和HBx蛋白在HBV相关性肝癌组织中高表达,且具有明显的正相关性。利用组织芯片技术结合临床病人资料,作者发现肝癌癌灶组织中的ARRB1强阳性表达提示更大的肿瘤直径,而癌灶组织中的ARRB1也往往提示预后不良,这一结果与TCGA公共数据库中的结论一致(图1)。
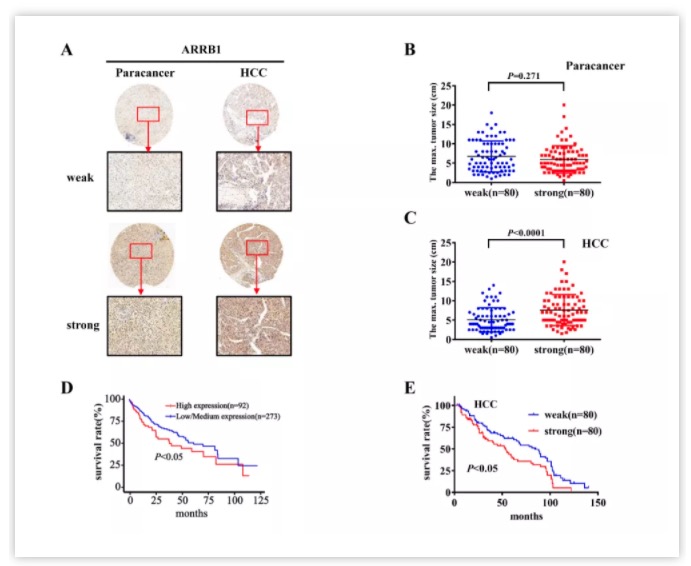
图1.ARRB1与HBV相关性HCC患者预后不良相关
研究者引入了HBx转基因小鼠(HBx-TG),该小鼠18个月时会自发出现肝细胞癌。作者发现HBx-TG小鼠肝组织中的ARRB1表达明显高于野生型(WT)小鼠。同样过表达HBx也促进了ARRB1的表达和激活。这一结果在人永生化的肝细胞系LO2,多种肝癌细胞系,以及人原代肝细胞中均得到了验证。有趣的是,作者还发现尽管HBx并不是一个传统的转录因子却可以结合到ARRB1启动子区,促进ARRB1的激活。
接着,研究团队培育了HBx过表达且ARRB1敲除的转基因小鼠(HBx+/+/Arrb1-/-),作者发现无论是在HBx诱导的18个月自发性肝细胞癌模型中还是用小剂量DNE(5mg/kg)加速诱导的肝细胞癌变模型中,HBx+/+/Arrb1-/-小鼠在肝脏肿瘤大小、直径等指标上均低于HBx+/+/Arrb1+/+小鼠(图2)。这一结果提示,ARRB1可以促进HBx诱导的肝细胞癌变。
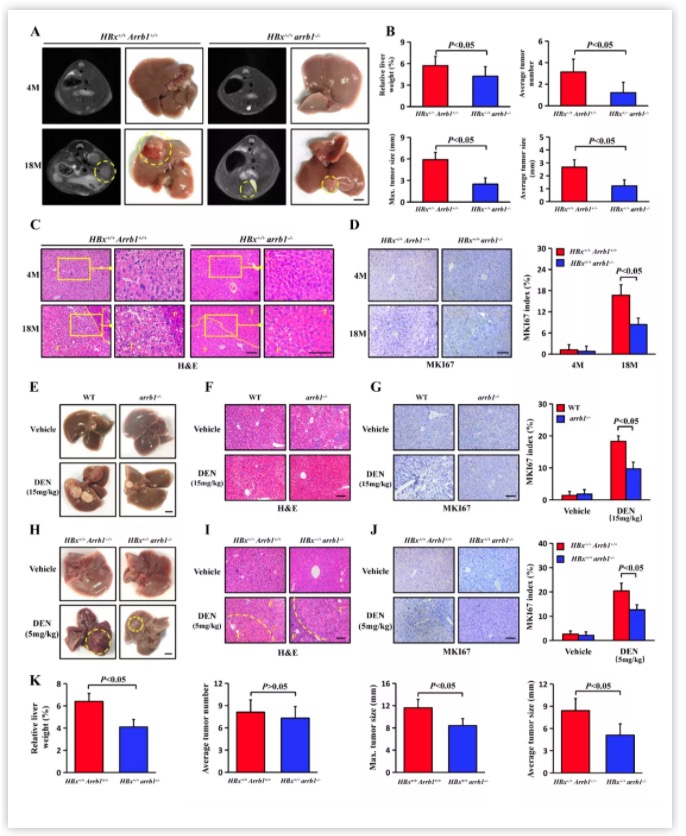
图2.在HBx-TG小鼠中,ARRB1缺失抑制了自发性和低剂量DEN诱导的肝细胞癌变
随后作者利用石蜡切片的免疫组化染色、western blot、电镜、免疫荧光等技术证实了肝癌中自噬增强,且HBx促进了细胞中自噬的高表达。作者利用吉凯基因的慢病毒产品构建了HBx过表达的LO2和HepG2细胞系,并利用吉凯基因的LC3荧光双标慢病毒系统(stubRFP-sensGFP-LC3 Lentivirus)监测自噬流(autophagy flux)的表达情况,发现干扰ARRB1表达后HBx引起的自噬升高受到抑制,尤其是黄色荧光代表的自噬小体(图3)。动物模型的结果也与细胞一致。
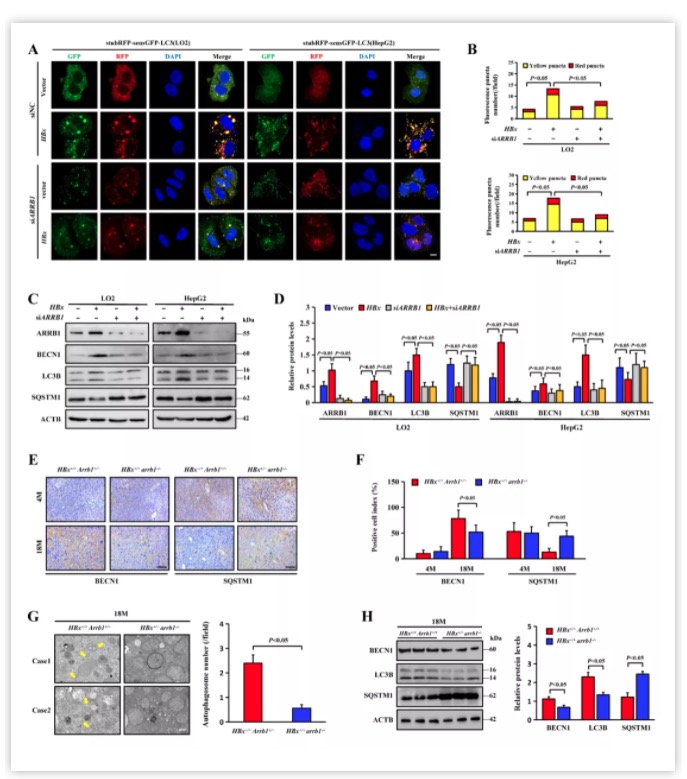
图3.ARRB1的缺失抑制了HBx诱导的自噬小体形成
进一步作者利用免疫荧光、免疫共沉淀和GST pulldown等技术发现ARRB1可以作为支架蛋白促进HBx与LC3的结合,尤其是I型LC3,从而介导HBx促进I型LC3向II型LC3转化。由于之前的研究发现,ARRB1与肝癌病人肿瘤的大小有关,因此作者想了解ARRB1是否影响HBx引起的肿瘤生长。研究人员发现,无论是用3-MA抑制自噬还是用小干扰RNA(siRNA)干扰自噬相关基因ATG5和ATG7的表达,均阻碍了HBx引起的细胞周期加速(主要是G1/S期)。更重要的是,研究人员发现抑制自噬主要影响了HBx诱导的CDK2磷酸化水平升高,并不是影响CDK2总量的变化。另一方面,作者利用吉凯基因的慢病毒产品构建了ARRB1敲低的LO2和HepG2细胞系。研究发现,尽管HBx过表达促进了细胞周期加速,但干扰ARRB1表达后HBx引起的细胞周期加速被抑制。以上结果提示,ARRB1介导的自噬在HBx诱导的G1/S期加速中扮演了重要的作用(图4)。
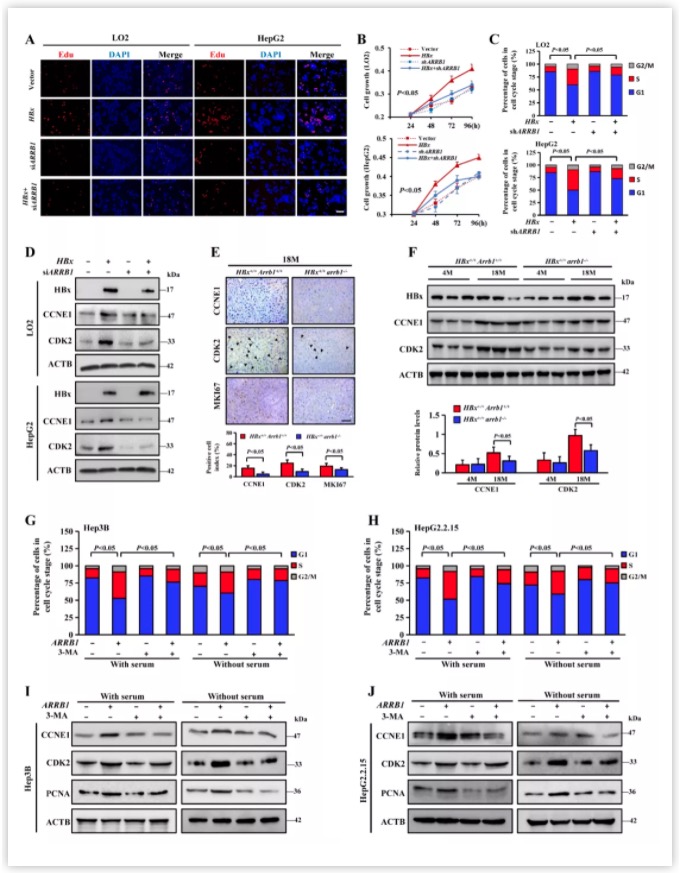
图4 在HBx诱导的增殖中,ARRB1的缺失通过下调自噬来促进G1/S的阻滞
最后,作者阐明了ARRB1介导的自噬如何调控HBx引起的细胞周期改变。研究者发现抑制自噬主要影响了G1/S期检查点的CDK2-CCNE1复合物的活性,而该复合物的抑制蛋白CDKN1B不仅可以通过蛋白酶体途径降解,亦可以通过选择性自噬的方式去降解,进而调控CDK2-CCNE1复合物的激活。

1.ARRB1作为一种癌基因在HBV相关性肝癌组织中表达增高,且高表达提示预后不良;
2. HBx可以促进并激活ARRB1表达,ARRB1缺失抑制了HBx诱导的肝细胞癌变;
3.ARRB1可作为支架蛋白招募HBx和LC3B结合,从而介导肝细胞癌中自噬小体的形成;
4. 抑制ARRB1介导的自噬阻碍了HBx诱导的G1/S期加速,这一过程依赖对CDKN1B-CDK2-CCNE1-E2F1信号轴的调节。
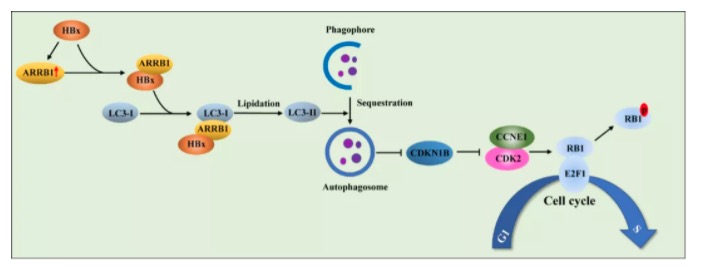
图5.在HBV相关性HCC中,ARRB1介导的自噬促进HBx诱导的肝细胞癌变的机制图

该研究中构建多种稳定转染细胞株的慢病毒LV-HBx、LV-ARRB1、LV-ARRB1-shRNA(GV112载体),及监测自噬水平的荧光双标慢病毒stubRFP-sensGFP-LC3均由吉凯基因提供,实现高效稳定的基因过表达或敲低。

中山大学附属第三医院消化内科吴斌教授和杨逸冬副教授为论文共同通讯作者,中山大学博士研究生雷一鸣为论文第一作者。该研究得到国家自然基金-广东省联合基金重点项目(U1501224)及广东省自然基金研究团队项目(2018B030312009)等项目资助。
© 2023 GENECHEM All RIGHTS RESERVED .
© 2023 GENECHEM All RIGHTS RESERVED .
